炭酸飲料の缶を開けると、ヘンリーの法則の例が聞こえてきます。缶を開けると、炭酸ガスの圧力が急激に下がります。ヘンリーの法則によれば、飲み物に含まれる二酸化炭素の濃度も減少します。あなたが聞くシューという音は、液体から逃げる二酸化炭素です。ヘンリーの法則の詳細については、以下をご覧ください。
ヘンリーの法則とは?
ヘンリーの法則は、液体上の気体の分圧と液体に溶解している気体との関係を説明しています。一般に、圧力が高いほど、より多くの気体が液体に溶解します。この関係は次の式で表されます:
溶解度 =ヘンリー定数 * 気体の分圧
Cg =kPg
Cg =溶存ガス濃度
K =ヘンリー定数
Pg =ガスの分圧
方程式の定数は、検査対象のガスに依存します。方程式については、例とともに以下で詳しく説明します。
複数のガスが存在する場合でも使用できます。大気化学と環境研究では、大気と水系の間を行き来するガスを調査する際に、一般的にヘンリーの法則を利用しています。
ヘンリーの法則定数
ヘンリーの法則の定数は、実験によって決定されます。液体の上の気体の圧力を注意深く制御し、溶液中の濃度を測定します。定数は、濃度を異なる点での分圧で割ることによって実験的に決定されます。
定数の単位は通常 mol*m*Pa で、mol*L*atm と同じです。分数形式では、これらの単位は次のように表示されます:
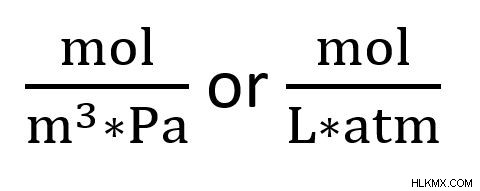
ヘンリーの法則の定数のリスト
以下は、水中のいくつかの一般的なガスのヘンリーの法則の定数のリストです。より完全なリストはこのペーパーで見つけることができ、以下にリストされている定数のソースです。このリンクには、上記の論文に基づく定数の検索可能なデータベースもあります。
| 水中ガス | ヘンリーの法則定数 (mol*m*Pa) | ヘンリーの法則定数 (mol*L*atm) |
| 臭化水素 (HBr) | 0.24 | 24.3 |
| 過塩素酸 (HClO4 ) | 9.9 * 10 | 1.0 * 10 |
| フッ化水素 (HF) | 1.3 * 10 | 1.32 * 10 |
| 硝酸 (HNO3 ) | 2.1 * 10 | 2.12 * 10 |
| 水素 (H2 ) | 7.7 * 10 | 7.8 * 10 |
| 重水素 (D2 ) | 7.9 * 10 | 8.0 * 10 |
| 酸素 (O2 ) | 1.2 * 10 | 1.2 * 103 |
| 臭素 (Br2 ) | 7.2 * 10 | 0.73 |
| 二酸化硫黄 (SO2 ) | 1.2 * 10 | 1.22 |
| メタン (CH4 ) | 1.4 * 10 | 1.41 * 10 |
| ベンゼン (C6 H6 ) | 1.8 * 10 | 0.18 |
ヘンリーの法則の限界
ヘンリーの法則が正確でないことが証明される状況がいくつかあります。
まず、システムは平衡状態にある必要があります。システムが平衡状態にない場合、法則に基づく溶液中の濃度は不正確になります。平衡とは何かについては、この ChemTalk 記事を参照してください。
ガスが溶媒と反応する場合も、式はうまく機能しません。この反応は、ヘンリーの法則がその状況に当てはまらないことを意味します。
そして 3 番目の制限は、法律が高濃度と高圧力で崩壊することです。
問題例
質問 #1: 水素の分圧が 3 気圧のとき、水中の水素濃度は?
答えと解決策 #1: この問題に答えるために、法則からの方程式を使用します。上の表から、水中の水素のヘンリー定数は 7.8 * 10 mol*L*atm であることがわかります。
Cg =k * Pg
濃度 =7.8 * 10 (mol*Latm) * 3気圧
濃度 =2.34 * 10 mol/L
これらの問題では単位に注意を払うことを忘れないでください。分圧は atm で与えられたので、問題では atm の単位を使用する Henry の定数を使用します。
質問 #2: 水サンプルの濃度が 7.8 * 10 mol/L の場合、空気中のメタンの分圧を計算します。
答えと解決策 #2: この問題では、分圧について解いています。そこで、方程式を再編成することから始めます。
Cg =k * Pg
Cg / k =Pg
次に、既知の値を組み込みます。定数は、値のテーブルから取得されます。水中のメタンは上の表にあります。
(7.8 * 10-4 mol/L) / (1.41 * 10 mol*L*atm) =Pg
Pg =0.55 気圧
ウィリアム・ヘンリーとは?
ウィリアム・ヘンリーは、19 世紀初頭に研究した英国の化学者でした。彼は 1775 年から 1836 年まで生きました。彼の研究はガスの溶解度に焦点を当てており、ヘンリーの法則は彼にちなんで名付けられました。
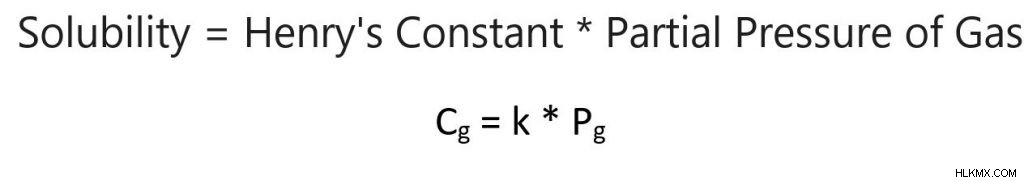
他の気体および溶解度に関する法則へのリンク
- 混合ガス法
- 理想気体の法則
- ボイルの法則
- 平衡定数
- ゲイ リュサック法