主な違い - マグネシウムと酸化マグネシウム
マグネシウムは、元素周期表の第 2 族に属するアルカリ土類金属です。多くの塩基性化合物を形成することができます。マグネシウムは、マグネシウム二価陽イオンを形成することにより、イオン性化合物を形成することがよくあります。酸化マグネシウムは、そのようなイオン化合物の 1 つです。白い固体です。マグネシウムと酸化マグネシウムの主な違いは、マグネシウムが化学元素であるのに対し、酸化マグネシウムはイオン化合物であることです。
対象となる主な分野
1.マグネシウムとは
– 定義、化学的性質
2. 酸化マグネシウムとは
– 定義、化学的性質
3.マグネシウムと酸化マグネシウムの違いは何ですか
– 主な相違点の比較
重要な用語:焼成、吸湿性、マグネシウム、水酸化マグネシウム、酸化マグネシウム

マグネシウムとは
マグネシウムは、記号 Mg を持つ化学元素です。それは、元素の周期表のグループ 2、期間 3 に配置されます。マグネシウムの原子番号は 12 です。これは、マグネシウムが核内に 12 個の陽子を持っていることを意味します。室温および圧力条件では、マグネシウムは固相です。マグネシウムの電子配置は[Ne]3sです。したがって、0 および +2 の酸化状態を持つことができます。
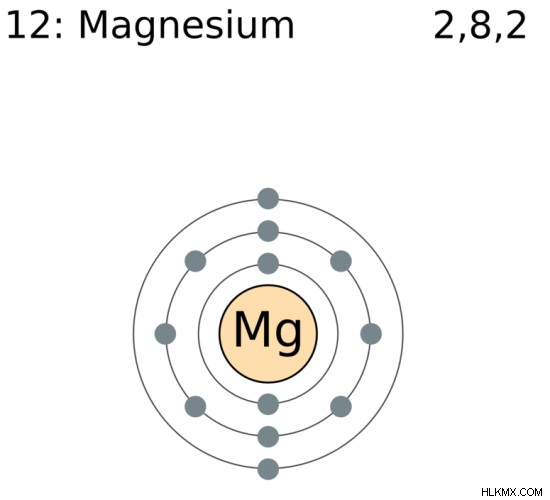
図 1:マグネシウムの化学構造
マグネシウムの融点は約 650℃です。マグネシウムの原子質量は 24 amu として与えられます。周期表の s ブロックにあります。マグネシウムと同じグループの他の元素は、アルカリ土類金属と見なされます。これは、それらが形成する酸化物が基本的な特性を持っているためです。マグネシウムの電気陰性度は約1.31です。マグネシウムの原子半径は約 160 pm です。
マグネシウムは主に鉱床に見られます。そのような鉱物には、ドロマイトとマグネサイトが含まれます。海水にもかなりの量のマグネシウムイオンが溶け込んでいます。マグネシウムは、特に航空機の設計や自動車の設計において、金属として幅広い用途があります。
酸化マグネシウムとは
酸化マグネシウムは、化学式 MgO を持つ無機化合物です。この化合物のモル質量は 40.304 g/mol です。吸湿性のある白色の粉末です。これは、大気にさらされたときに空気から水を吸収できることを意味します.
酸化マグネシウムは無臭で、沸点は 360℃ です。この化合物の融点は約280℃です。酸化マグネシウムの飽和溶液のpH値は10.3です。したがって、それは塩基性化合物です。

図 2:酸化マグネシウムのサンプル
酸化マグネシウムは、マグネシウムイオンと酸化物イオンが格子状に並んだイオン化合物です。陽イオンと陰イオンの間にはイオン結合があります。この化合物を水に加えると、水酸化マグネシウムが形成されます。しかし、水酸化マグネシウムを加熱すると、再び酸化マグネシウムになります。酸化マグネシウムは、炭酸マグネシウムまたは水酸化マグネシウムをか焼することで製造できます。
マグネシウムと酸化マグネシウムの違い
定義
マグネシウム: マグネシウムは、記号 Mg を持つ化学元素です。
酸化マグネシウム: 酸化マグネシウムは、化学式 MgO を持つ無機化合物です。
モル質量
マグネシウム: マグネシウムのモル質量は 24 g/mol です。
酸化マグネシウム: 酸化マグネシウムのモル質量は 40.304 g/mol です。
自然
マグネシウム: マグネシウムは化学元素です。
酸化マグネシウム: 酸化マグネシウムはイオン性化合物です。
融点
マグネシウム: マグネシウムの融点は約 650°C です。
酸化マグネシウム: 酸化マグネシウムの融点は約 2800°C です。
外観
マグネシウム: マグネシウムは光沢のある銀灰色の外観をしています。
酸化マグネシウム: 酸化マグネシウムは白い粉です。
結論
マグネシウムは、酸化マグネシウムがイオン化合物である化学元素です。これがマグネシウムと酸化マグネシウムの主な違いです。マグネシウムは、軽量であるのに比べて強度が高いため、非常に有用な金属元素です.