コンセプト
このチュートリアルでは、電子配置の見つけ方と書き方を学びます 周期表を使用したさまざまな元素の軌道図。アウフバウの原理、フントの法則、パウリの排他原理を学びます。このチュートリアルが気に入ったら、以下にリンクされている他のチュートリアルもチェックしてください!
関連記事
- 分子構造
- ルイス構造
- 電子軌道と軌道形状
電子配置
電子配置は、電子が分子または原子のどこにあるかを表したものです。電子は、特徴的なエネルギー レベルを持つ軌道を占有します。電子の数が多い系は、より多くのエネルギー準位を占有します。つまり、より高いエネルギー準位を利用することになります。電子配置は、標準的な表記法または軌道図を使用して表されます。
電子配置の書き込み
電子配置には、電子が占める主なエネルギー準位とサブ準位を示す標準的な表記法があります。ヘリウムの電子配置は次のとおりです:
1秒
最初の整数 1 は、原理エネルギー レベルを示します 、文字 s は 軌道 (サブレベル) のタイプを表します 、上付き文字 2 から 電子占有率 が得られます .この場合、主エネルギー準位が 1 の s 軌道に 2 つの電子があります。
電子の数が多い系は、より多くのエネルギー準位を占有します。リチウムの電子配置は次のとおりです。
1 秒 2 秒
3 つの電子を含むリチウムは、最初のエネルギー レベルで s 軌道を占有する 2 つの電子と、2 番目のエネルギー レベルで s 軌道を占有する 1 つの電子を持っています。
周期表は、これらの構成を記述するのに役立つツールです。主エネルギー準位は、周期表の周期に対応する整数 (1、2、3、…7) で示されます。連続する各整数は、通常、最後の整数よりも高いエネルギー レベルを表します。サブレベルは、文字 s、p、d、および f で示されます。周期表のグループまたはブロックは同じサブレベルを共有し、次の図に示すように分割されます。
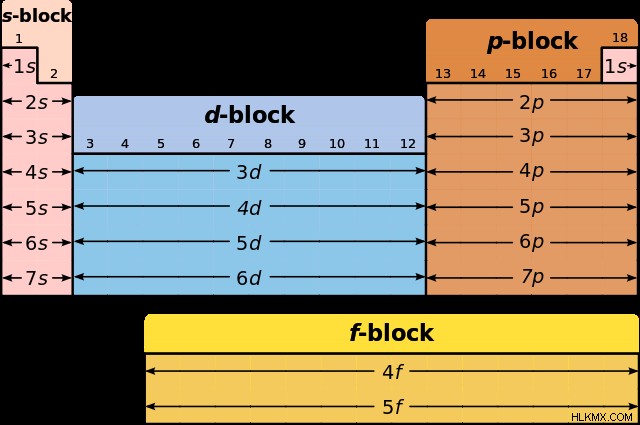
電子配置の書き込み – 例
元素の電子配置を見つけるには、水素から始めて、目的の元素に到達するまで各周期をトレースします。先行する各要素で、それが表すエネルギー レベルとブロックに注意してください。以下のこのセクションで練習しましょう。
リチウム
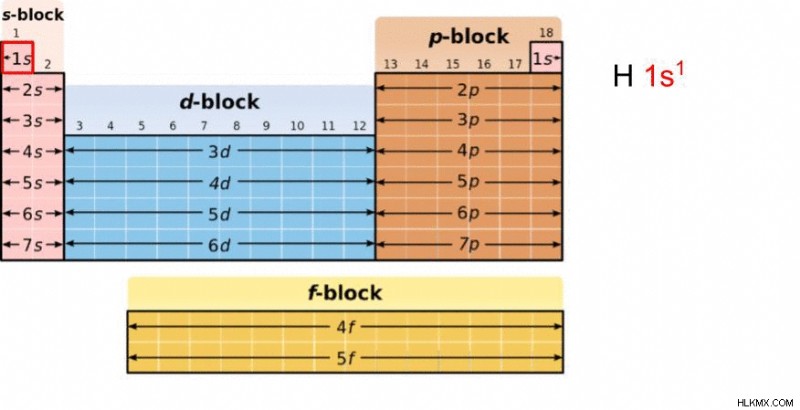
もう一度、リチウムの例を使用します。水素 (1s) から始めて、ヘリウム (1s)、そしてリチウム (2s) に移ります。したがって、リチウムの電子配置は 1s 2s です .
注:リチウムの電子配置の前半は、水素とヘリウムの間でエネルギー準位と軌道が変わらないため、「1s1s」ではなく「1s」のみを使用して記述されます。上付き文字を 1 から 2 に変更することで、電子占有率のみが変化します。
カーボン

リチウムの例と同じように、水素から始まる周期表に従ってください。炭素は第 2 周期と p ブロックにあるため、最高エネルギーの電子は 2p 軌道を占有します。電子殻配置は 1s2s2p です。炭素は周期表の 6 番であり、したがって 6 個の電子を持っていることに注目することで、この答えを再確認することもできます。炭素配置の各軌道の電子を数えると、2+2+2=6 になります!
リン
では、周期表でリンを見つけてみましょう。これは、第 3 ピリオドの p ブロック内にあります。さらに、それは15個の電子を持っています。リンの電子殻配置は 1s2s2p3s3p になります。
電子配置の書き方 – 簡単な方法
必要に応じて、すべてのサブシェルを書き出すこともできますが、時間を節約するために、電子配置の簡略法を知っておくとよいでしょう。簡単な方法では、18 族の元素である希ガスをブックマークとして使用します。
臭素
臭素は p ブロックのピリオド 4 にあります。電子配置の場合、焦点を当てている要素に到達するまで、左から右に、周期を下に作業することを忘れないでください。臭素のために渡された最後の希ガスは、アルゴン (Ar) でした。簡単な方法を使用して、アルゴンをこの [Ar] のように括弧で囲み、アルゴンの後に電子配置を続けます。次のようになります:[Ar] 4s3d4p.
塩素
塩素は、p ブロックのピリオド 3 にあります。塩素のために渡された最後の希ガスはネオン (Ne) でした。簡単な方法を使用して、ネオンを括弧に入れ、電子配置を続けます。次のようになります:[Ne] 3s2 3p5.
軌道図とは?
電子配置を表す別の方法は、軌道図を使用することです。軌道図では、軌道はボックスで表され、電子は矢印 (↑ または ↓) で表され、各軌道/ボックスを占める 2 つの電子があります。軌道は、主なエネルギーレベルとサブレベル (1s、2p など) に従ってラベル付けされます。 1s 軌道に 2 つの電子を持つヘリウムの軌道図は次のとおりです。
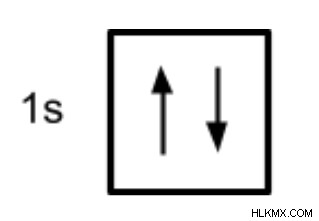
軌道図をうまく描くには、これらの軌道がどのように満たされるかを決定するいくつかの原則に注意する必要があります。
アウフバウの原理
Aufbau はドイツ語で「構築」を意味するため、この規則はエネルギー状態に基づいて軌道がどのように満たされるかを決定します。この原理は、低エネルギーの電子軌道が高エネルギーの軌道より先に満たされると述べています。したがって、1s 軌道は 2s 軌道の前に満たされ、2s 軌道は 2p 軌道の前に満たされます。ただし、4s シェルは 3d シェルよりもエネルギーが低いため、4s シェルは 3d シェルよりも先に充填されます。
以下の例では、構成 A は完全に占有された 1s 軌道と半分占有された 2s 軌道を示しています。構成 B は、半分占有された 1s 軌道と、完全に占有された 2s 軌道を示しています。アウフバウの原理に基づいて、リチウムの電子配置はどれだと思いますか?
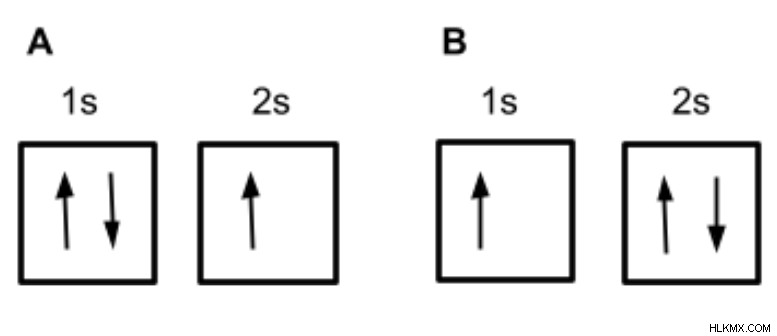
1s 軌道は 2s 軌道よりもエネルギーが低いため、最初に 1s 軌道を満たし、残りの電子を 2s 軌道を満たすために使用して、構成 A をリチウムの正しい軌道図にする必要があります。
次に、軌道が同じエネルギーである場合、軌道をどのように埋めますか?
フンドの法則
フントの法則は、同じエネルギーの軌道がどのように満たされるべきかを決定します。 2 つの電子が同じ軌道を占有する前に、これらの軌道のそれぞれに 1 つの電子が与えられます。単一電子も同じスピンを持ちます (軌道図の矢印の方向で示されます)。
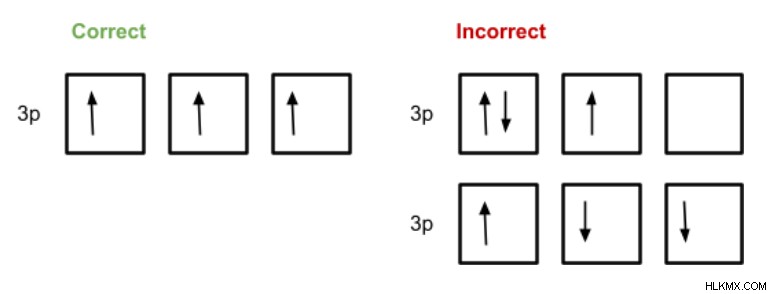
正しい構成では、1 つの電子が各軌道を満たし、各電子は同じスピンを持ちます。最初の誤った構成は、軌道に 2 つの電子を追加する前に、すべての軌道が半分満たされていたわけではないことを示しています。そして 2 番目の正しい例では、すべての単一電子が同じスピンを持っているわけではありません。
酸素の 3 つの 2p 軌道はどのように占められるべきですか?

2 つの電子が軌道を占有する前にすべての軌道が単独で占有されており、すべての単一電子が同じスピンを持っているため、オプション A は正しい構成です。
パウリ排除原則
パウリの排他原理は、原子または分子内の 2 つの電子が同じ 4 つの量子数を持つことはできないと述べています。私たちの目的では、これは、同じ軌道を占める 2 つの電子が同じスピンを持つことができないことを意味します。 1 つはスピン アップ (↑) で、もう 1 つはスピン ダウン (↓) でなければなりません。
2 つの電子を含む 1s 軌道の正しい軌道図はどれですか?
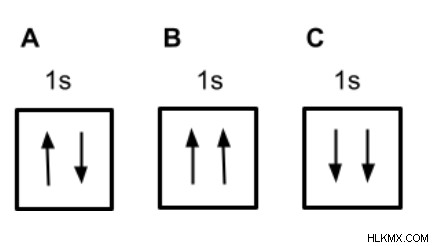
矢印の方向で示されているように、電子は反対のスピンを持っているため、構成 A は正しいです。
注:上向きの最初の矢印を描くことも慣習です。
電子配置 – 参考文献
- 周期表の読み方
- 原子の構造







