主な違い - 窒素と硝酸塩
窒素は、周期表の 15 族の化学元素です。水素、酸素、炭素などのさまざまな他の元素と結合することにより、さまざまな種類の分子やイオンを形成できます。硝酸塩は、窒素原子が 3 つの酸素原子に結合して陰イオンを形成するイオンの 1 つです。硝酸イオンは、さまざまな陽イオンや硝酸エステルなどの共有結合化合物と結合することによって、さまざまな塩化合物を形成することができます。窒素と硝酸塩の主な違いは、窒素は化学元素ですが、硝酸塩は陰イオンです。
対象となる主な分野
1.窒素とは
– 定義、化学的性質
2.硝酸塩とは
– 定義、硝酸化合物
3.窒素と硝酸塩の違いは何ですか
– 主な相違点の比較
重要な用語:アミド、アミン、陰イオン、陽イオン、共有結合、硝酸塩、窒素、窒素循環、酸素、相対原子質量、共鳴

窒素とは
窒素は周期表の 15 族の化学元素で、化学記号は「N」です。窒素は、その電子配置によると p ブロック要素です。 [彼] 2s2p. 窒素の原子番号は 7 で、相対原子質量は約 14 amu です。室温と標準圧力では、窒素は無色、無臭、無味の二原子気体化合物として存在します。

図 1:窒素の原子構造
窒素には 3 つの不対電子があります。電子殻を完成させるために、3つの共有結合を形成する傾向があります。窒素はN2として存在します 大気中のガス。二原子共有結合化合物です。 2 つの窒素原子の間には三重結合があります。
窒素には、N-14 と N-15 の 2 つの安定同位体があります。しかし、N-14 は最も安定で最も豊富な同位体です。この同位体の存在量は約 99% です。窒素はさまざまな化合物を形成します。いくつかの例には、アミド、アミン、硝酸塩、窒化物、アジド、酸化物、シアン化物などが含まれます。
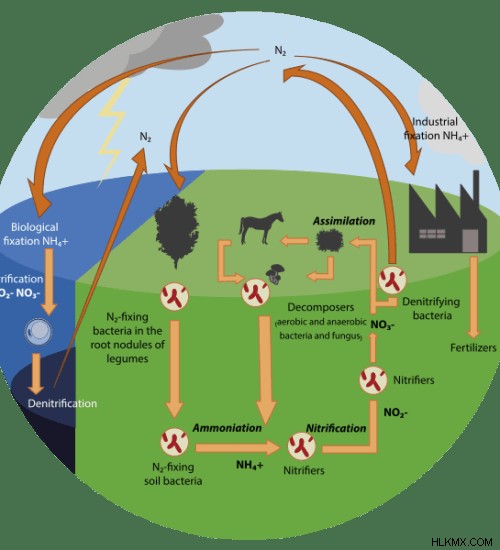
図 2:窒素循環
窒素循環は、環境中の窒素の循環を示しています。窒素は地球上の生命にとって不可欠な元素です。それは、核酸、タンパク質などの多くの重要な生物学的分子の化学組成に含まれています。したがって、窒素は大気中、生物内部、土壌中に発生し、それらの間を循環しています.
硝酸塩とは
硝酸塩は、化学式 NO3 を持つ陰イオンです。 .このイオンのモル質量は 62 g/mol です。それは共有結合化合物です。ルイス構造では、2 つの酸素原子が単結合で窒素原子に結合し、もう 1 つの酸素原子が二重結合で結合しています。したがって、硝酸イオンは共鳴構造を持っています。しかし、このイオンの実際の構造は、すべての共鳴構造のハイブリッド構造です。複合体の形状は三角平面です。
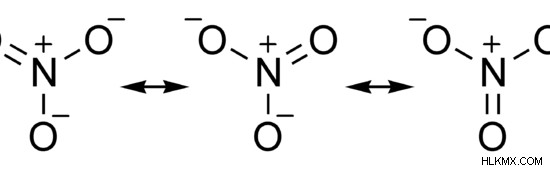
図 2:硝酸イオンの共鳴構造
硝酸イオンがプロトンに結合すると、硝酸と呼ばれます。硝酸は、有機化学におけるほとんどの合成反応の重要な成分です。たとえば、ニトロベンゼンは、ベンゼンを硝酸、硫酸、および水の混合物と反応させることによって合成されます。
硝酸イオンは、塩として、および遊離の水性イオンとしてイオン化合物に含まれています。硝酸塩は、鉱床として地球上で一般的です。いくつかの例には、硝酸アンモニウム、硝酸ナトリウム、硝酸カリウムなどがあります。硝酸塩は、陽イオンに結合した硝酸イオンから構成されるイオン化合物です。硝酸塩の共有結合化合物には、硝酸のエステルが含まれます。
窒素循環では、硝化細菌 (ニトロバクター )亜硝酸イオンを硝酸イオンに変換します。ただし、脱窒細菌 (シュードモナスなど) ) は硝酸塩を窒素ガスに変換できます。
窒素と硝酸塩の違い
定義
窒素: 窒素は周期表の 15 族の化学元素で、化学記号は「N」です。
硝酸塩: 硝酸塩は、化学式 NO3 の陰イオンです。 .
自然
窒素: 窒素は化学元素です。
硝酸塩: 硝酸塩は陰イオンです。
電荷
窒素: 窒素原子には正味の電荷はありません。
硝酸塩: 硝酸イオンは -1 の電荷を持っています。
窒素循環
窒素: 窒素元素は、アンモニア、亜硝酸塩、硝酸塩などのさまざまな形で窒素循環を循環します。
硝酸塩: 窒素循環中の硝化細菌はアンモニウムイオンを硝酸イオンに変換し、脱窒細菌は硝酸イオンを窒素ガスに変換します。
化合物
窒素: 窒素は、無機化合物や有機化合物など、さまざまな化合物を形成します。
硝酸塩: 硝酸イオンは、塩や共有結合化合物に見られます。
結論
窒素は化学元素です。硝酸イオンは-1の電荷を持つ陰イオンです。窒素はさまざまな形で窒素循環を循環していることがわかりますが、硝酸イオンは硝化と脱窒の段階で見られます。窒素と硝酸塩の主な違いは、窒素が化学元素であるのに対し、硝酸塩は陰イオンであることです.