フッ素は、原子番号 9 を持つ記号 F の化学元素です。最も軽いハロゲンとしても知られるフッ素は、淡黄色の非常に毒性の高い二原子ガスとして STP に存在します。最も電気陰性度の高い元素であるフッ素は、希ガスのアルゴン、ネオン、ヘリウムを除く、周期表のすべての元素と反応するため、非常に反応性が高いです。
フッ素は 2p 殻に 5 つの電子を持っています。このため、フッ素が最も電気陰性度の高い元素であることがわかっています。 2pの電子配置。軌道には合計 6 個の電子が含まれており、フッ素は理想的な電子配置に非常に近いように見えます。高い電気陰性度は、フッ素の半径が小さいことをさらに説明します。電子は原子核の近くに詰め込まれているからです。正の陽子は、負の電子に対して強い引力を持ち、より大きくて電気陰性度の低い元素と比較して、それらを核に密接に無傷のままに保ちます.
ガスフロンについてはご存知かもしれません。それらは、二酸化炭素よりも地球温暖化に大きな影響を与える温室効果ガスです.SF6は、既知の物質の中で最も高い地球温暖化係数を持っています.炭素とフッ素の結合が強いため、有機フッ素化合物は周囲に留まることができます。哺乳類に見られるフッ素の代謝的役割は知られていません.
F2 の結合エネルギーは、Cl2 または Br2 の結合エネルギーよりもはるかに低くなります。これは、高い電気陰性度に加えて、容易なフッ素解離、高い反応性、および非フッ素原子への強い結合の理由です。
フッ素は電気陰性度が高いため、他の原子と形成される結合は非常に強力です。
同様に、鉄粉、ガラスの破片、アスベスト繊維などの非反応性の物質でさえ、低温ではフッ素ガスと急速に反応します。フッ素は、地球の地殻で最も一般的な元素として 13 位を占めています。フッ素は自然界には存在しないと考えられていますが、フッ素元素が存在することが知られています。
フッ素の反応には、有機物質と無機物質の両方を含む豊富な化学反応が見られます。フッ素は、ほぼすべての希ガス、メタロイド、金属、非金属と結合します。 -1の酸化状態のみを占めます。
フッ素の反応は次のとおりです:
フッ素は水素と即座に反応し、化合物フッ化水素を形成します。この反応は、特定の条件下で爆発的になる可能性があります。
H2(g) + F2(g) → 2 HF(g)
HF は、蛍石 CaF2 と硫酸との吸熱反応によっても生成されます:
CaF2 + H2SO4 → 2 HF(g) + CaSO4
形成された化合物である HF は、肥料生産の副産物であり、ヘキサフルオロケイ酸 H2SiF6 を生成します。フッ素の高い電子親和力は、イオン結合を優先します。フッ素によって形成される共有結合は極性があり、ほとんどの場合、単一であることがわかります。これは分解され、加水分解によって熱的に HF を放出する可能性があります:
H2SiF6 → 2 HF + SiF4
SiF4 + 2 H2O → 4 HF + SiO2
フッ素と金属/金属イオンとの反応
ナトリウム、Na はフッ素と反応し、F2 はフッ化ナトリウム、NaF を形成します:
2 Na(s) + F2(g) 2 NaF(s)
上記の金属との反応は、ほとんどの金属に対して行うことができる一般的な反応です。
フッ素と希ガスの反応
クリプトンはフッ素 F2 と反応し、-196 °C (液体窒素) の非常に低い温度に冷却され、放電または X 線で検出され、化合物クリプトン (II ) フッ化物、KrF2
Kr(s) + F2(s) KrF2(s)
この化合物は、室温まで加熱すると分解します。
キセノンはフッ素、F2 と反応します
Xe(g) + 2 F2(g) XeF4(s)、400 °C でガスを混合し、-78 °C に冷却
Xe(g) + F2(g) XeF2(s)
Xe(g) + 3 F2(g) XeF6(s)
フッ化キセノンは、他のキセノン化合物の合成に使用されます。
ラドンをフッ素 F2 と反応させることができます。分子の正確な式は不明で、通常 RnFn と表記されます
硫黄とフッ素の反応
硫黄は過剰なフッ素と反応して、フッ化硫黄(VI)を形成します:
S(s) + 3 F2(g) SF6(s)
フッ素は SO2 と反応して SO2F2 を形成します:
SO2(g) + F2(g) SO2F2(g)
フッ素と水との反応
フッ素は水と反応します:
F2(g) + H2O(l) O2(g) + OF2(aq) + H2O2(aq) + HF(aq)
反応条件によって、反応のバランスが決まります。
元素フッ素はわずかに塩基性です。つまり、水と反応するとフッ化水素酸を形成します
自然界にはほとんど存在しませんが、人工化合物に使用されています.
アルカリ金属は、イオン性で溶解性の高い一フッ化物を形成します。
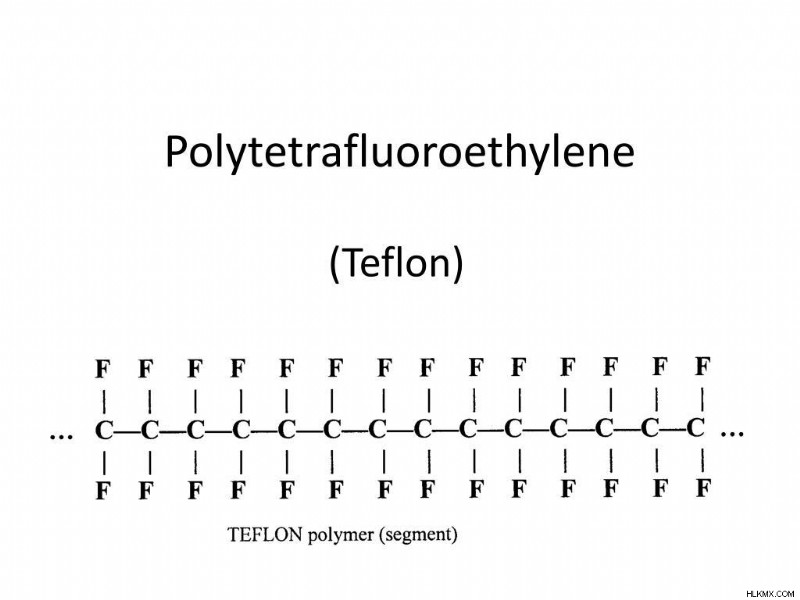
ポリテトラフルオロエチレン (PTFE)、最も単純なフルオロポリマーであり、構造単位 –CF2- を持つポリエチレンのパーフルオロ類似体です。
結論
これで、フッ素の反応と電気陰性度がわかりました。しかし、私たちの身の回りのどこにフッ素が存在するか知っていますか?虫歯予防のために毎日の水道水にフッ素が添加されています。フッ化ナトリウム(NaF)、フッ化第一スズ(II)、(SnF2)、およびモノフルオロリン酸ナトリウム(Na2PO3F)はすべて、歯磨き粉に添加されるフッ素化合物で、虫歯の予防にも役立ちます。六フッ化ウラン (UF6) は、原子炉で使用されるウランの同位体を分離するために使用されます。蛍石や蛍石としても知られるフッ化カルシウム、CaF2 は、赤外光に焦点を合わせるのに役立つレンズの製造に使用されます。フッ素は周期表の特別な元素です。







