主な違い – パラジウムとプラチナ
パラジウムとプラチナは見た目が似ているため、よく混同されます。どちらも光沢のある銀白色の金属です。これらの金属は、パラジウム、ロジウム、ルテニウム、オスミウム、イリジウム、および白金を含む白金族金属 (PGM) に属します。パラジウムとプラチナはどちらも遷移金属であり、同じ電気陰性度を持っています。しかし、それらの化学的性質は互いに異なります。パラジウムとプラチナの主な違いは、パラジウムは PGM 元素の中で密度と融点が最も低く、プラチナは密度が非常に高く融点が高いことです。
対象となる主な分野
1.パラジウムとは
– 定義、化学的性質、用途
2.プラチナとは
– 定義、化学的性質、用途
3.パラジウムとプラチナの違いは何ですか
– 主な違いの比較
重要な用語:酸、原子番号、王水、耐食性、密度、融点、パラジウム、プラチナ、プラチナ族金属
パラジウムとは
パラジウムは記号 Pd を持つ化学元素です 原子番号46。光沢のある銀白色の金属です。室温および圧力では、それは固相にあります。パラジウムは、常温で空気や酸による腐食に耐性があります。
パラジウムの化学的性質
パラジウムの化学的性質の一部を以下に示します。
- 原子番号 – 46
- 原子量 – 106.42 g/mol
- 電子配置 – [Kr] 4d
- グループ – 10
- ピリオド – 5
- ブロック – d (遷移金属)
- 融点 – 8°C
- 沸点 – 2963°C
- 電気陰性度 – 2.2 (ポーリング スケール)
- 密度 – 12.0 g/cm

図 1:パラジウム
パラジウムは、ロジウム、ルテニウム、オスミウム、イリジウム、プラチナとともに、プラチナ族金属と呼ばれます。 (PGM)。パラジウムの外観はプラチナの外観に非常に似ています。パラジウムは、白金族金属の他の化学元素の中で最小の密度と融点を持っています.
パラジウムは、単位セルが立方体の形をした「面心立方」結晶構造を持っています。パラジウムはある程度耐食性がありますが、濃硝酸、硫酸などの高温の酸に侵されます。パラジウムは王水 (硝酸と塩酸の混合物) に溶解する場合があります。
パラジウムは標準温度では酸素と反応しないため、空気に触れても変色しません。しかし、硫黄を含む湿った雰囲気では、パラジウムはわずかに変色します。
パラジウムの用途
パラジウムの用途には次のようなものがあります。
- 触媒として使用 (細かく分割されたパラジウムは、水素化、脱水素化、および石油分解反応を加速するために使用されます)
- 低電圧電気接点に使用 (耐食性のため)
- ジュエリー作り (「ホワイトゴールド」と呼ばれる合金を形成 – プラチナとの合金)
- 時計の軸受け、科学機器の鏡、バネなどを作るため
- 自動車の触媒コンバーターとして使用 (自動車の排気ガスを削減するため)
- 電気めっき (パラジウム塩を使用)
プラチナとは
プラチナは記号 Pt を持つ化学元素です 原子番号 78 です。光沢のある銀白色の外観をしています。金と同様に非反応性が高く、耐腐食性に優れています。プラチナは白金族金属のメンバーです。
プラチナの化学的性質
プラチナの化学的性質の一部を以下に示します。
- 原子番号 – 78
- 原子量 – 195.084 g/mol
- 電子配置 – [Xe] 4f5d6s
- グループ – 10
- ピリオド – 6
- ブロック – d (遷移金属)
- 融点 – 2°C
- 沸点 – 3825°C
- 電気陰性度 – 2.2 (ポーリング スケール)
- 密度 – 21.5 g/cm

図 2:プラチナ
プラチナは遊離金属 (結合していない) として漂砂鉱床で発見されます。プラチナは最も反応性の低い金属の 1 つです。
純粋なプラチナは延性があり、展性があり、光沢があります。金や銀と比較すると、プラチナは延性に優れていますが、可鍛性は劣ります。プラチナは濃硝酸や濃塩酸と反応しませんが、高温の王水 (硝酸と塩酸の混合物) には溶解します。
プラチナの用途
プラチナの用途の一部を以下に示します。
- ジュエリーとして(その強度と変色に対する耐性のため)
- 自動車、トラック、バスの触媒コンバーターとして (車両のエンジンからの排出物を有害性の低い廃棄物に効率的に変換するため。
- 硝酸、シリコーン、ベンゼン製造の触媒として
- 電極に使用されるワイヤーとして
- 医療用 (プラチナ化合物は化学療法薬として使用されます)
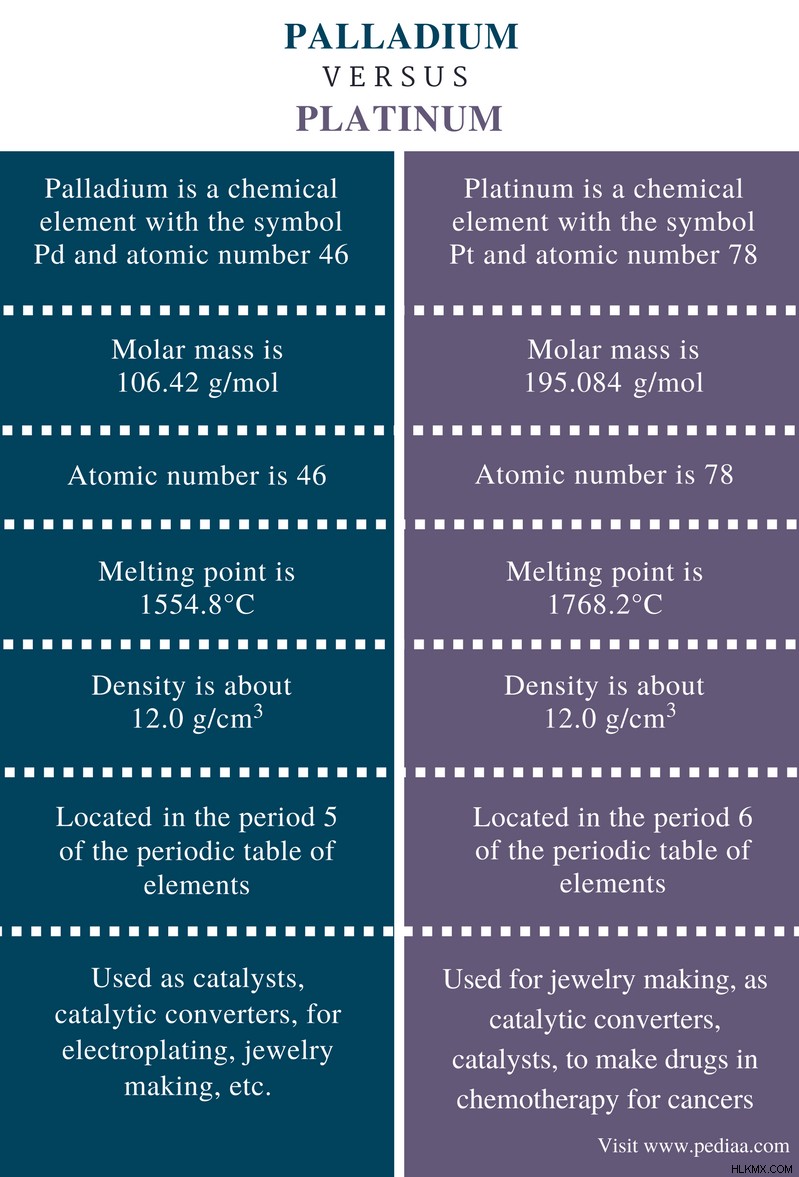
パラジウムとプラチナの違い
定義
パラジウム: パラジウムは、記号 Pd と原子番号 46 の化学元素です。
プラチナ: プラチナは、記号 Pt と原子番号 78 の化学元素です。
原子番号
パラジウム: パラジウムの原子番号は 46 です。
プラチナ: プラチナの原子番号は 78 です。
原子質量
パラジウム: パラジウムの原子量は 106.42 g/mol です。
プラチナ: プラチナの原子量は 195.084 g/mol
融点
パラジウム: パラジウムの融点は 1554.8°C です。
プラチナ: プラチナの融点は1768.2℃です
密度
パラジウム: パラジウムの密度は約 12.0 g/cm です。
プラチナ: パラジウムの密度は約 21.5 g/cm です。
期間
パラジウム: パラジウムは、元素の周期表の周期 5 にあります。
プラチナ: プラチナは、元素の周期表の周期 6 にあります。
用途
パラジウム: パラジウムは、触媒、触媒コンバーター、電気メッキ、ジュエリー製作などに使用されます。
プラチナ: プラチナは、宝石の製造、触媒コンバーター、触媒として、癌の化学療法で薬を作るために使用されます.
結論
パラジウムとプラチナは、外観が似ている非常に重要な金属です。これらの金属にはさまざまな用途があります。似ているように見えますが、それらの間には多くの化学的な違いがあります。パラジウムとプラチナの主な違いは、PGM 元素の中でパラジウムの密度と融点が最小であるのに対し、プラチナはかなり高密度で融点が高いことです。
参照:
1. 「パラジウム – 元素情報、特性、用途 |周期表。"王立化学会、こちらから入手可能。
2.「水処理ソリューション」。
3.「プラチナ – 元素の情報、特性、および用途 |周期表。"王立化学会、こちらから入手可能。
画像提供:
1. 化学元素の高解像度画像による「パラジウム (46 Pd)」 – (CC BY 3.0) コモンズ ウィキメディア経由
2. 「プラチナ (ロシア) 3 (17151299739)」ジェームズ セント ジョン – プラチナ (ロシア) 3 (CC BY 2.0) コモンズ ウィキメディア経由







