主な違い - 電子利得エンタルピーと電気陰性度
電子は、原子の素粒子です。すべての物質は原子で構成されているため、電子はどこにでもあります。ただし、電子の交換がこれらの反応の反応物と生成物の唯一の違いであるため、一部の化学反応では電子が非常に重要です。電子利得エンタルピーと電気陰性度は、電子と原子の結合を説明するために使用される 2 つの化学用語です。電子獲得エンタルピーは、電子が外部から獲得されたときに原子によって放出されるエネルギーの量です。電気陰性度は、原子が外部から電子を獲得する能力です。したがって、電子利得エンタルピーは電気陰性度を定量化します。電子ゲイン エンタルピーと電気陰性度の主な違いは、電子ゲイン エンタルピーが kJ/mol 単位で測定されるのに対し、電気陰性度は単位がなく、ポーリング スケールで測定されることです。
対象となる主な分野
1.電子利得エンタルピーとは
– 定義、単位、発熱および吸熱反応
2.電気陰性度とは
– 定義、測定単位、周期変動
3.電子利得エンタルピーと電気陰性度の違いは何ですか
– 主な相違点の比較
重要な用語:原子、電子、電子親和力、電気陰性度、電子ゲイン エンタルピー、吸熱、発熱、ポーリング スケール

電子ゲイン エンタルピーとは
電子獲得エンタルピーは、中性の原子または分子が外部から電子を獲得したときのエンタルピーの変化です。つまり、中性の原子または分子 (気相中) が外部から電子を受け取るときに放出されるエネルギーの量です。したがって、電子利得エンタルピーは、単に電子親和力に使用される別の用語です。電子獲得エンタルピーの測定単位は kJ/mol です。
新しい電子の追加により、負に帯電した化学種が形成されます。これは次のように記号で表すことができます。
X + e → X + エネルギー
ただし、電子利得エンタルピーと電子親和力には違いがあります。電子獲得エンタルピーは、電子を獲得したときに周囲に放出されるエネルギーを表し、電子親和力は、電子を獲得したときに周囲に吸収されるエネルギーを表します。したがって、電子利得エンタルピーは負の値であり、電子親和力は正の値です。基本的に、両方の用語は同じ化学プロセスを表します。

図 1:水素の電子配置は 1s1 です。電子殻を埋めるためにもう1つの電子を獲得して安定することができます。したがって、電子獲得エンタルピーは、この電子獲得の負の値です。
電子利得エンタルピーは、電子が原子にどれだけ強く結合しているかを示します。放出されるエネルギー量が大きいほど、電子利得エンタルピーが大きくなります。電子獲得エンタルピーの値は、電子が獲得される原子の電子配置に依存します。中性原子または分子に電子が付加されると、エネルギーが放出されます。これを発熱反応といいます。この反応によりマイナスイオンが発生します。電子利得エンタルピーは負の値になります。しかし、このマイナスイオンに別の電子を加えようとすると、その反応を進めるためにエネルギーを与える必要があります。これは、入ってくる電子が他の電子によって反発されるためです。この現象は吸熱反応と呼ばれます。ここで、電子獲得エンタルピーは正の値になります。
電気陰性度とは
電気陰性度とは、原子が外部から電子を引き寄せる能力です。これは原子の定性的性質であり、各元素の原子の電気陰性度の値を比較するために、相対的な電気陰性度の値が存在するスケールが使用されます。この尺度は「ポーリング尺度」と呼ばれます 」このスケールによると、原子が持つことができる電気陰性度の最大値は 4.0 です。他の原子の電気陰性度の値は、電子を引き付ける能力を考慮して値が与えられます。
電気陰性度は、元素の原子番号と原子のサイズによって異なります。周期表を考慮すると、フッ素 (F) は小さな原子であり、価電子が原子核の近くにあるため、電気陰性度の値は 4.0 となります。そのため、外部から電子を引き寄せやすいのです。さらに、フッ素の原子番号は 9 です。オクテット規則に従うために、もう1つの電子のための空軌道があります。そのため、フッ素は外部から電子を引き寄せやすいのです。
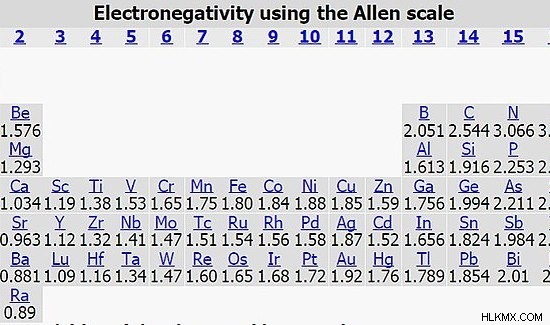
図 2:アレン スケールは、原子の電気陰性度を示すために使用される別のスケールです。ただし、ポーリング スケールは、4.0 が最大電気陰性度値である一般的に使用されるスケールです。
電気陰性度により、2 つの原子間の結合が極性になります。一方の原子が他方の原子より電気陰性度が高い場合、電気陰性度の高い原子が結合の電子を引き付けることができます。これにより、周囲の電子が不足しているため、他の原子は部分的に正の電荷を帯びます。したがって、電気陰性度は、化学結合を極性共有結合、非極性共有結合、およびイオン結合として分類するための鍵となります。イオン結合は 2 つの原子間に発生し、電気陰性度に大きな違いがありますが、共有結合は原子間に電気陰性度にわずかな違いがある場合に発生します。
元素の電気陰性度は周期的に変化します。元素の周期表には、電気陰性度の値に応じて元素がより適切に配置されています。周期表の周期を考慮すると、各元素の原子サイズは、周期の左から右に向かって減少します。これは、価電子殻に存在する電子の数と核内の陽子の数が増加し、電子と核の間の引力が徐々に増加するためです。したがって、原子核からの引力が増加するため、同じ期間に沿って電気陰性度も増加します。そうすれば、原子は外部から容易に電子を引き寄せることができます.
電子ゲイン エンタルピーと電気陰性度の違い
定義
電子利得エンタルピー: 電子獲得エンタルピーは、中性原子または分子が外部から電子を獲得するときのエンタルピーの変化です。
電気陰性度: 電気陰性度は、外部から電子を引き付ける原子の能力です。
測定単位
電子利得エンタルピー: 電子利得エンタルピーは kJ/mol で測定されます。
電気陰性度: 電気陰性度には単位がなく、ポーリング スケールを使用して測定されます。
測定
電子利得エンタルピー: 電子利得エンタルピーはエネルギー量を測定します。
電気陰性度: 電気陰性度は、電子を獲得する能力を測定します。
値
電子利得エンタルピー: 電子獲得エンタルピーは、電子を獲得しようとしている原子の電子配置に応じて、正または負のいずれかになります。
電気陰性度: 電気陰性度は常に正の値です。
結論
電子獲得エンタルピーは、原子が外部から電子を獲得するときに放出されるエネルギー量を測定します。電気陰性度は、原子が外部から電子を受け取る能力を測定します。電子ゲイン エンタルピーと電気陰性度の主な違いは、電子ゲイン エンタルピーが kJ/mol 単位で測定されるのに対し、電気陰性度は単位がなく、ポーリング スケールで測定されることです。
参照:
1.「電子利得エンタルピー - 化学、クラス 11、元素の分類と特性の周期性」。 ClassNotes.org.in、2017 年 3 月 28 日、こちらから入手可能。
2. 「電気陰性度」 Chemistry LibreTexts、Libretexts、2017 年 9 月 29 日、こちらから入手可能。
画像提供:
1.「電子殻 001 水素 – ラベルなし」by commons:User:Pumbaa (commons によるオリジナル作品:User:Greg Robson) (対応するラベル付きバージョン) (CC BY-SA 2.0 uk)、Commons Wikimedia 経由
2. 「アレンの電気陰性度の図」Mcardlep – (CC BY-SA 4.0)
コモンズ ウィキメディア経由







