主な違い – 電子親和力とイオン化エネルギー
電子は原子の素粒子です。電子の振る舞いを説明する多くの化学概念があります。電子親和力とイオン化エネルギーは、化学における 2 つの概念です。電子親和力は、中性の原子または分子が電子を獲得するときに放出されるエネルギーの量です。電子親和力は、意味を考慮すると電子利得エンタルピーとも呼ばれますが、電子利得エンタルピーは、原子が電子を獲得するときに周囲に吸収されるエネルギーの量を表すため、これらは異なる用語です。一方、イオン化エネルギーは、原子から電子を取り除くのに必要なエネルギー量です。電子親和力とイオン化エネルギーの主な違いは、電子親和力は原子が電子を獲得するときに放出されるエネルギー量を与えるのに対し、イオン化エネルギーは原子から電子を除去するのに必要なエネルギー量であることです。
対象となる主な分野
1.電子親和力とは
– 定義、吸熱および発熱反応
2.イオン化エネルギーとは
– 定義、第一イオン化、第二イオン化
3.電子親和力とイオン化エネルギーの類似点は何ですか
– 共通機能の概要
4.電子親和力とイオン化エネルギーの違いは何ですか
– 主な相違点の比較
重要な用語:原子、電子、電子親和力、電子利得エンタルピー、第一イオン化エネルギー、イオン化エネルギー、第二イオン化エネルギー

電子親和力とは
電子親和力は、中性の原子または分子 (気相中) が外部から電子を受け取るときに放出されるエネルギー量です。この電子の追加により、負に帯電した化学種が形成されます。これは次のように記号で表すことができます。
X + e → X + エネルギー
中性の原子または分子に電子が付加されると、エネルギーが放出されます。これを発熱反応といいます。この反応によりマイナスイオンが発生します。しかし、このマイナスイオンに別の電子を加えようとすると、その反応を進めるためにエネルギーを与える必要があります。これは、入ってくる電子が他の電子によって反発されるためです。この現象は吸熱反応と呼ばれます。
したがって、同じ種の第 1 電子親和力は負の値であり、第 2 電子親和力の値は正の値です。
第一電子親和力:X(g) + e → X(g)
第二電子親和力:X (g) + e → X (g)
電子親和力は、周期表で周期的な変動を示します。これは、入ってくる電子が原子の最も外側の軌道 に追加されるためです。周期表の元素は、原子番号の昇順に並べられています。原子番号が大きくなると、最も外側の軌道にある電子の数が増えます。
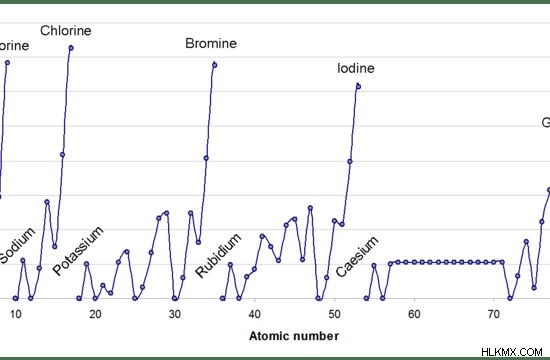
図 1:周期表の周期に沿った電子親和力の変化
一般に、電子の数は周期に沿って増加するため、電子親和力は左から右への周期に沿って増加するはずです。したがって、新しい電子を追加することは困難です。実験的に分析すると、電子親和力の値は、徐々に増加するパターンではなく、ジグザグ パターンを示します。
イオン化エネルギーとは
イオン化エネルギーは、気体原子が最も外側の軌道から電子を取り除くために必要なエネルギー量です。これはイオン化エネルギーと呼ばれます。これは、原子が電子を1つ取り去った後に正電荷を取得し、正電荷を帯びたイオンになるためです。ある元素の原子は別の元素の原子とは異なるため、すべての化学元素には特定のイオン化エネルギー値があります。たとえば、1 番目と 2 番目のイオン化エネルギーは、原子が 1 つの電子と別の電子をそれぞれ除去するのに必要なエネルギー量を表します。
第一イオン化エネルギー
第一イオン化エネルギーは、ガス状の中性原子が最も外側の電子を取り除くために必要なエネルギー量です。この最も外側の電子は、原子の最も外側の軌道にあります。したがって、この電子は、その原子の他の電子の中で最も高いエネルギーを持っています。したがって、最初のイオン化エネルギーは、原子から最高エネルギーの電子を放出するのに必要なエネルギーです。この反応は本質的に吸熱反応です。
この概念は中性荷電原子に関連付けられています。これは、中性荷電原子は、要素を構成する元の数の電子のみで構成されているためです。ただし、そのために必要なエネルギーは元素の種類によって異なります。すべての電子が原子内で対になっている場合、より高いエネルギーが必要です。不対電子がある場合、それはより低いエネルギーを必要とします。ただし、値は他のいくつかの事実にも依存します。たとえば、原子半径が大きい場合、最も外側の電子が原子核から遠く離れているため、必要なエネルギー量は低くなります。すると、この電子と原子核の間の引力は低くなります。そのため、簡単に取り外すことができます。しかし、原子半径が小さい場合、電子は原子核に強く引き付けられ、原子から電子を取り除くのが難しくなります。
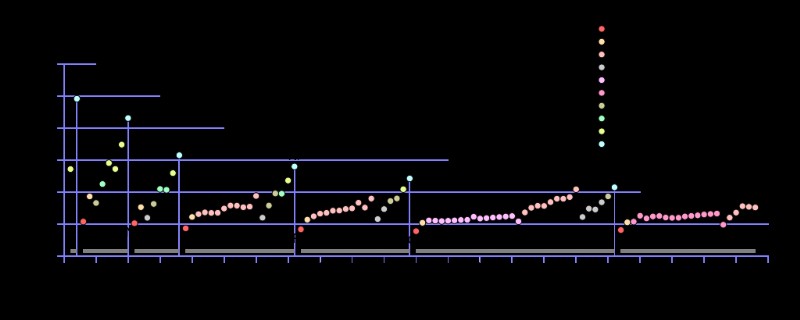
図 2:いくつかの化学元素の変化する第一イオン化エネルギーのパターン
第二イオン化エネルギー
第 2 イオン化エネルギーは、ガス状の正に帯電した原子から最も外側の電子を取り除くのに必要なエネルギー量として定義できます。中性に帯電した原子から電子を取り除くと、正の電荷が生じます。これは、原子核の正電荷を中和するのに十分な電子がないためです。このプラスに帯電した原子から別の電子を取り除くには、非常に高いエネルギーが必要です。このエネルギー量は、第 2 イオン化エネルギーと呼ばれます。
2 番目のイオン化エネルギーは常に 1 番目のイオン化エネルギーよりも高い値になります。これは、中性に帯電した原子よりも正に帯電した原子から電子を除去することが非常に難しいためです。
電子親和力とイオン化エネルギーの類似点
- どちらもエネルギー関連の用語です。
- 電子親和力とイオン化エネルギーの値は、対象となる原子の電子配置によって異なります。
- どちらも周期表のパターンを示しています。
電子親和力とイオン化エネルギーの違い
定義
電子親和力: 電子親和力は、中性の原子または分子 (気相中) が外部から電子を獲得するときに放出されるエネルギーの量です。
イオン化エネルギー: イオン化エネルギーは、気体原子が最も外側の軌道から電子を取り除くために必要なエネルギー量です。
エネルギー
電子親和力: 電子親和力は、周囲へのエネルギーの放出を表します。
イオン化エネルギー: イオン化エネルギーは、外部からのエネルギーの吸収を表します。
電子エネルギー
電子親和力: 電子親和力は、電子獲得を説明するために使用されます。
イオン化エネルギー: イオン化エネルギーは、電子の除去を説明するために使用されます。
結論
電子親和力とイオン化エネルギーは、電子と原子の挙動を定量的に説明するために使用される 2 つの化学用語です。電子親和力とイオン化エネルギーの主な違いは、電子親和力は原子が電子を獲得するときに放出されるエネルギー量を与えるのに対し、イオン化エネルギーは原子から電子を除去するのに必要なエネルギー量であることです。
参照:
1.「電子親和力」。
2. Chemistry LibreTexts、Libretexts、2017 年 11 月 14 日、こちらから入手可能。
3. 電子親和力、Chem Guide、こちらから入手可能。ヘルメンスティン、アン・マリー。 「イオン化エネルギーの定義と傾向」。 ThoughtCo、2017 年 2 月 10 日、こちらから入手可能。
画像提供:
1. 「元素の電子親和力」Sandbh 著 – Commons Wikimedia による自著 (CC BY-SA 3.0)
2. “First Ionization Energy” By Sponk (PNG ファイル)Glrx (SVG ファイル)Wylve (zh-Hans, zh-Hant)Palosirkka (fi)Michel Djerzinski (vi)TFerenczy (cz)Obsuser (sr-EC, sr-EL, hr) . png by Sponk (CC BY 3.0)、Commons Wikimedia 経由







