主な違い – sp vs sp vs sp ハイブリダイゼーション
軌道は、電子で満たすことができる仮説上の構造です。さまざまな発見によると、科学者はこれらの軌道のさまざまな形状を提案しています。軌道には、主に原子軌道、分子軌道、混成軌道の 3 種類があります。原子の原子軌道は混成を受けて、化学結合に適した軌道を作ります。化学では、ハイブリダイゼーションとは、異なる原子軌道を混合して混成軌道を形成することです。 sp、sp 、sp 混成軌道など、さまざまな形の混成軌道を作るさまざまな形の混成があります。これらの軌道は、s 原子軌道と p 原子軌道が異なる比率で混成することによって形成されます。 sp sp と sp ハイブリダイゼーションの主な違いは、sp ハイブリダイゼーションは 50% s 軌道特性を持つハイブリッド軌道を形成し、sp ハイブリダイゼーションは 33% s 軌道特性を持つハイブリッド軌道を形成するのに対し、sp ハイブリダイゼーションは 25% s 軌道特性を持つハイブリッド軌道を形成することです。
対象となる主な分野
1. spハイブリダイゼーションとは
– S および P 特性の定義、計算、その他の機能
2. spハイブリダイゼーションとは
– S および P 特性の定義、計算、その他の機能
3. spハイブリダイゼーションとは
– S および P 特性の定義、計算、その他の機能
4. sp sp と sp ハイブリダイゼーションの違いは何ですか
– 主な相違点の比較
重要な用語:原子軌道、ハイブリッド軌道、ハイブリダイゼーション、軌道、Sp ハイブリダイゼーション、SpHybridization、SpHybridization
sp ハイブリダイゼーションとは
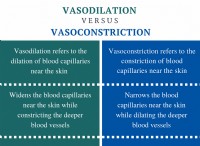
sp 混成は、s 原子軌道と p 原子軌道の間で行われる混成です。電子殻には 3 つの p 軌道が含まれています。したがって、s軌道がこれらのp軌道の1つと混成した後、その原子には混成されていない2つのp軌道が存在します。ここでは、すべての s 軌道と p 軌道を単なる原子軌道 (s+p) と見なします。 s 軌道と p 軌道の比率は 1:1 です。したがって、s 軌道の割合は 1/2 で、p 軌道の割合は 1/2 です。
S (または p) 特性パーセンテージ =全原子軌道 x (1/2) x 100%
=50%

図 1:sp ハイブリダイゼーション
結果として得られる混成軌道は、s 特性の 50% と p 特性の 50% を持ちます。混成軌道は 2 つしか形成されないため、sp 軌道の空間配置は線形です。 2 つの混成軌道は反対方向を向いています。したがって、これらの軌道間の角度は 180°です。
spHybridization とは
sp ハイブリダイゼーションは、1 つの s 原子軌道と 2 つの p 原子軌道の混合です。新しく形成された混成軌道は、sp混成軌道として知られています。結果として得られる混成軌道には、約 33.33% の s 文字と約 66.66% の p 文字があります。これは、合計 3 つの原子軌道が混成に関与しており、s と p の特性の割合が次のように変化するためです。
ここで、すべての s 軌道と p 軌道を単なる原子軌道 (s+p+p) と見なします。 s 軌道と p 軌道の比率は 1:2 です。したがって、s 軌道の割合は 1/3 で、p 軌道の割合は 2/3 です。
S 特性パーセンテージ =全原子軌道 x (1/ 3) x 100%
=33.33 %
P 特性パーセンテージ =全原子軌道 x (2 / 3) x 100%
=66.66 %
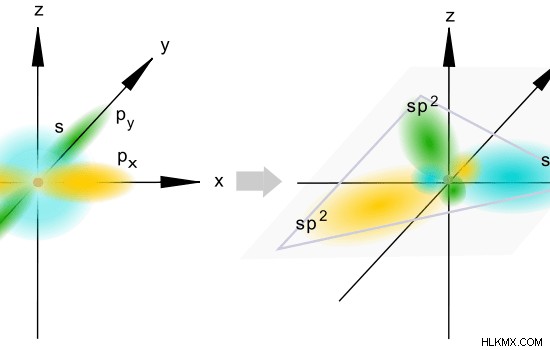
図 2:sp ハイブリダイゼーション
sp 混成軌道の空間配置は三角平面です。したがって、これらの軌道の間の角度は 120° です。このハイブリダイゼーションを受ける原子には、3 つの p 軌道のうち 2 つだけがこのハイブリダイゼーションに関与するため、1 つのハイブリダイズしていない p 軌道があります。
sp ハイブリダイゼーションとは
sp ハイブリダイゼーションは、1 つの s 原子軌道と 3 つの p 原子軌道の混合です。ここでは、3 つの p 軌道すべてが混成に関与しているため、原子には混成されていない p 軌道はありません。結果として生じる軌道は、spハイブリッド軌道として知られています。スポビタルと同様に、これらの軌道の s 特性と p 特性を計算できます。
sp 混成では、すべての s 軌道と p 軌道を単なる原子軌道 (s+p+p+p) と見なします。 s 軌道と p 軌道の比率は 1:3 です。したがって、s 軌道の割合は ¼ であり、p 軌道の割合は ¾ です。
S 特性パーセンテージ =全原子軌道 x (1/4) x 100%
=25 %
p 特性パーセンテージ =全原子軌道 x (3 /4) x 100%
=75 %
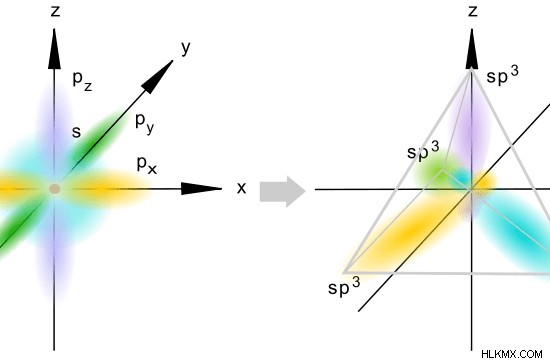
図 3:sp ハイブリダイゼーション
これらの軌道は、1 つの s 軌道と 3 つの p 軌道が混成したときに形成されます。結果として得られる混成軌道には、約 25% の s 文字と約 75% の p 文字があります。これらの軌道の空間配置は四面体です。したがって、これらの軌道間の角度は 109.5C です。
sp sp と sp ハイブリダイゼーションの違い
定義
sp ハイブリダイゼーション: sp ハイブリダイゼーションは、s 原子軌道と p 原子軌道の間で起こるハイブリダイゼーションです。
sp ハイブリダイゼーション: sp ハイブリダイゼーションは、1 つの s 原子軌道と 2 つの p 原子軌道の混合です。
sp ハイブリダイゼーション: sp ハイブリダイゼーションは、1 つの s 原子軌道と 3 つの p 原子軌道の混合です。
S 特性
sp ハイブリダイゼーション: sp 混成軌道の s 特性パーセンテージは 50% です。
sp ハイブリダイゼーション: sp 混成軌道の s 特性パーセンテージは 33.33% です。
sp ハイブリダイゼーション: sp 混成軌道の固有パーセンテージは 25% です。
混成軌道の P 特性パーセンテージ
sp ハイブリダイゼーション: sp 混成軌道の p 特性パーセンテージは 50% です。
sp ハイブリダイゼーション: sp 混成軌道の p 特性パーセンテージは 66.66% です。
sp ハイブリダイゼーション: スフィブリッド軌道の p 特性パーセンテージは 75% です。
軌道間の角度
sp ハイブリダイゼーション: sp 軌道間の角度は 180°C です。
sp ハイブリダイゼーション: 胞子間の角度は 120°C です。
sp ハイブリダイゼーション: 胞子間の角度は 109.5°C です。
ジオメトリ
sp ハイブリダイゼーション: sp ハイブリダイゼーションにおける軌道配列の形状は線形です。
sp ハイブリダイゼーション: スフィブリダイゼーションにおける軌道配置の幾何学は、三角平面です。
sp ハイブリダイゼーション: スフィブリダイゼーションにおける軌道配置の幾何学は四面体です。
ハイブリダイズしていない軌道の数
sp ハイブリダイゼーション: Sp ハイブリダイゼーションにより、ハイブリダイズしていない 2 つの p 軌道が生じます。
sp ハイブリダイゼーション: Sp ハイブリダイゼーションにより、ハイブリダイズしていない p 軌道が 1 つ生成されます。
sp ハイブリダイゼーション: Sp ハイブリダイゼーションは、ハイブリダイズしていない p 軌道にはなりません。
結論
化学における混成とは、異なる原子軌道を混合して、異なる特性を持つ新しい混成軌道を形成することです。 sp、sp、およびspハイブリダイゼーションがその例です。 sp、sp およびsp ハイブリダイゼーションの主な違いは、sp ハイブリダイゼーションは 50% s 軌道特性を持つハイブリッド軌道を形成し、sp ハイブリダイゼーションは 33% s 軌道特性を持つハイブリッド軌道を形成するのに対し、sp ハイブリダイゼーションは 25% s 軌道特性を持つハイブリッド軌道を形成することです。
参照:
1.「ハイブリッド軌道」。
2. Chemistry LibreTexts、Libretexts、2016 年 7 月 21 日、こちらから入手可能。 「軌道混成」。ウィキペディア、ウィキメディア財団、2018 年 1 月 15 日、こちらから入手可能。
画像提供:
1. Joanna Kośmiderによる「Hybrydyzacja sp」 – Commons Wikimedia経由の自身の作品(パブリックドメイン)
2. “Hybrydyzacja sp2” By Joanna Kośmider – Commons Wikimedia 経由の自身の作品 (パブリック ドメイン)
3. “Hybrydyzacja sp3” By Joanna Kośmider – Commons Wikimedia 経由の自身の作品 (パブリック ドメイン)