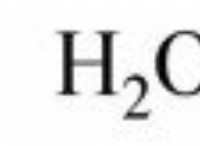シュウ酸二水和物には、化学式H2C2O4・2H2Oがあります。そのモル質量は、そのすべての構成原子のモル質量を追加することによって計算されます。
$$ 2 \ times12.01 \ text {g/mol c} + 2 \ times 1.01 \ text {g/mol h} + 4 \ times 16.00 \ text {g/mol o} + 2 \ times 18.02 \ text {g/mol h2o}
シュウ酸二水和物のモル質量は126.07 g/molです。
ステップ2:必要なシュウ酸二水和物のモル数を計算
次の式を使用して、特定の濃度の溶液を準備するために必要な溶質のモル数を計算できます。
臼歯(m)=溶質のモル /溶液の体積(L)
式を再配置すると、次のようになります。
溶質のモル=モル濃度(M)×溶液の体積(L)
この場合、シュウ酸二水和物溶液の望ましいモル極性は0.50 mで、調製する溶液の量は200 mLで、0.2 Lに相当します。
シュウ酸二水和物のモルが必要=0.50 m×0.2 l =0.1 mol
ステップ3:必要なシュウ酸二水和物の質量を計算
必要なシュウ酸二水和物のモル数がわかったので、そのモル質量を使用して対応する質量を計算できます。
シュウ酸二水和物の質量=シュウ酸二水和物×シュウ酸二水和物のモル質量のモル
私たちが持っている値を置き換える:
シュウ酸二水和物の質量=0.1 mol×126.07 g/mol =12.61 g
したがって、200 mLの0.50 mオキサル酸溶液を調製するには、12.61グラムのシュウ酸二水和物が必要です。