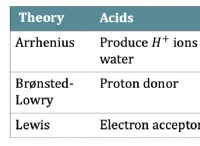
フッ素や酸素などの電気陰性度が高い原子は、電子を強く引っ張っています。これらの原子がナトリウムやカリウムなどの電気陰性の原子が少ない場合、電気陰性の原子は共有電子をより強く引き付け、それらを自分の核に近づけます。電子のこの不平等な共有は、イオンの形成につながります。
イオン結合では、電気陰性の原子がより少ない電気性原子から電子を獲得するため、それぞれ負に帯電したイオン(アニオン)と正の帯電イオン(カチオン)が形成されます。
たとえば、ナトリウム(Na)と塩素(Cl)原子がイオン結合を形成すると、高電気濃性塩素原子がナトリウム原子から電子を引き付け、ナトリウム陽イオン(Na+)と塩化物陰イオン(CL-)の形成をもたらします。
イオン結合の電子移動は、関与する両方の原子のより安定した電子構成を達成するために発生します。電子を獲得または失うことにより、原子は最も外側の電子シェルを完成させることができます。これにより、エネルギー状態が低くなり、安定性が向上することができます。