コア コンセプト
このチュートリアルでは、絆を極性にするものについて説明します 、極性共有結合の仕組み 定義、極性共有結合の例、最後に極性の問題を解決するための手順。
他の記事で取り上げるトピック
- 化学結合とは?
- 電気陰性
- 極性と非極性
- 水素結合
- イオン双極子力
結合の極性を決定するものは何ですか?
極性の特性は、分子または化合物全体の電荷の分布で構成されます。分子の両端に反対の電荷がある場合、分子は極性です。これらの電荷は、分子の原子間で電子が等しく共有されていないことに起因します。逆に、電子が分子全体で均等に共有されている場合、結合は無極性と見なされます。極性分子である水の一般的な例を調べて、不平等な共有の例を見てみましょう:
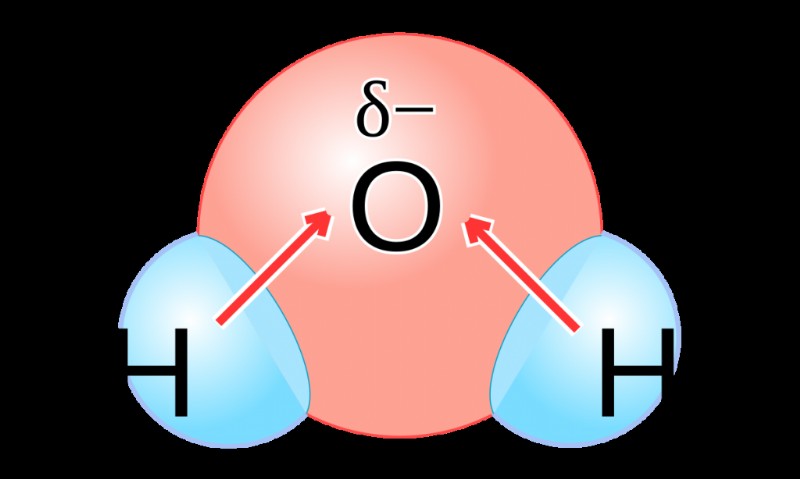
異なる原子は、それらがすでに持っている価電子の数に基づいて、異なる電気陰性度を持っています.異なる電気陰性度の原子は、不均等に電子を引き付けます。これにより、電子の共有が不均等になり、結合に極性が生じます。
極性結合とは?
極性結合とは何かについて説明しましょう。極性結合では、2 つの原子が不均等に電子を共有します。原子間には結合があり、電子は共有されますが、結合内の原子の 1 つに引き寄せられます。電子をより近くに引き寄せる原子はわずかに負の電荷を持ち、もう一方の原子は反対方向にわずかに正の電荷を持っています.
結合が極性共有結合と見なされるのはどのような場合ですか?
極性共有結合とは?
極性共有結合は、原子が共有結合で不均等に共有されている場合に発生します。具体的には、結合内の 2 つの原子の電気陰性度の差が 0.4 ~ 1.7 の場合です。 極性結合という用語 および 極性共有結合 通常、同じ意味で使用されます。
極性共有結合の例
| 絆 | 原子間の電気陰性度の違い | 分子内の例 |
| 酸素-水素 | 3.5 – 2.1 =1.4 | 水、H2 O |
| 二酸化炭素 | 3.0 – 2.5 =0.5 | 四塩化炭素、CCl4 |
| 窒素-水素 | 3.0 – 2.1 =0.9 | アンモニア、NH3 |
| 硫黄酸素 | 3.5 – 2.5 =1.0 | 二酸化硫黄、SO2 |
| 臭素水素 | 2.8 – 2.1 =0.7 | 臭化水素、HBr |
XeF2 ですか 極?
この問題を解決するために、次の手順を実行します:
<オール>XeF2 の唯一の結合 分子はキセノン-フッ化物結合です。この結合の原子は、キセノン (電気陰性度 2.6) とフッ化物 (電気陰性度 4.0) です。したがって、電気陰性度の差 =4.0 – 2.6 =1.4.
0.4 <1.4 <1.7 であるため、キセノン-フッ化物結合は極性共有結合です。
これが XeF2 のルイス構造です。 .
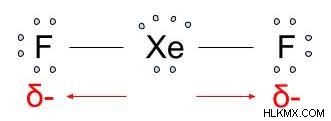
2 つのフッ化物原子は、キセノンよりも電気陰性度の値が高く、どちらも電子を引き寄せます。 XeF2だから の分子構造は線形であり、双極子は相殺されます。
したがって、XeF2 分子は非極性です 、その結合は極性共有結合ですが、 .
極性共有結合 – 参考文献
- ロンドン分散軍とファン デル ワールス軍
- イオン結合と共有結合
- 金属結合
- 結合エンタルピーと結合エネルギー







