ここに、陽イオンとそれらが見つけることができる周期表のグループのいくつかの一般的な例があります。
1。グループ1(アルカリ金属) :ナトリウム(Na+)、カリウム(K+)、リチウム(Li+)などのグループ1の元素は、1つの電子を容易に失い、Noble Gas Heliumと同様の安定した電子構成を実現します。それらは、+1電荷で単独の陽イオンを形成します。
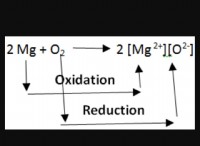
2。グループ2(アルカリの土金金属) :カルシウム(Ca2+)、マグネシウム(Mg2+)、ストロンチウム(Sr2+)を含むグループ2の元素は、2つの電子を失い、Noble Gas Neonに似た安定した構成を達成します。これらの元素は、+2電荷で二重の陽イオンを形成します。
3。遷移金属 :多くの遷移金属は、異なる電荷で陽イオンを形成できます。たとえば、鉄(Fe)はFe2+およびFe3+カチオンを形成でき、銅(Cu)はCu+およびCu2+イオンを形成でき、クロム(Cr)はCr2+およびCr3+カチオンとして存在できます。
4。移動後の金属 :アルミニウム(Al3+)、ガリウム(Ga3+)、インジウム(IN3+)などの移動後の金属グループの要素は、安定した電子構成を実現するために3つの電子を失う傾向があります。これらの要素は、+3電荷で三価の陽イオンを形成します。
5。非金属 :特定の非金属要素は、特定の条件下で陽イオンを形成することもできます。たとえば、共有化合物では、水素は電子を失い、正に帯電したH+イオンになる可能性があります。
要約すると、異なるグループの周期表全体にカチオンが見つかります。電子の喪失と結果として生じる正電荷はそれらを特徴づけます。アルカリ金属、アルカリの土金金属、遷移金属、移動後の金属、さらには、電子構成に応じて陽イオンを形成できます。