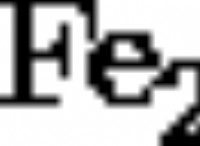酸 :プロトン(H+イオン)を寄付できる物質。
ベース :プロトン(H+イオン)を受け入れることができる物質。
化学反応では、酸はプロトンを塩基に伝達し、結合酸と共役塩基の形成をもたらします。コンジュゲート酸は、酸がプロトンを寄付した後に残っている種であり、コンジュゲートベースはプロトンを受け入れる種です。
たとえば、塩酸(HCl)が水と反応すると、HCl分子はプロトンを水分子に寄付し、共役酸H3O+(ヒドロニウムイオン)とコンジュゲート塩基Cl-(塩化物イオン)を形成します。
Hcl + H2O H3O + + cl-
Brønsted-Lowry理論は、水に溶解するとH+イオンを生成する物質として酸を定義し、水に水酸化物(OH-)イオンを水に溶解したときに水酸化物(OH-)イオンを生成する物質として定義するArrhenius理論よりも一般的です。
Brønsted-Lowry理論は、水性溶媒と非水溶液の両方の反応に適用でき、ガス中の酸と塩基の挙動を記述するためにも使用できます。
Brønsted-Lowry理論は、酸塩基化学を理解するための便利なツールです。酸塩基反応の生成物を予測するために使用できます。また、さまざまな環境での酸と塩基の挙動を説明するためにも使用できます。