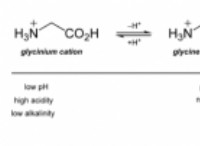
これがそれが意味することです:
* 前方反応: 矢印の左側の反応物は、右側の製品に変換されます。
* 逆反応: 矢印の右側にある製品は、左側の反応物に変換されます。
平衡 反応は、前方反応と逆反応の相対速度によって決定されます。前方速度がより速い場合、反応は製品の形成を支持します。逆速度がより速い場合、反応は反応物の形成を支持します。
例:
ヨウ化水素(HI)を形成するための水素(H₂)とヨウ素(I₂)の間の反応は、可逆反応です。
h₂(g) +i₂(g)⇌2hi(g)
これはつまり:
* 前方反応: 水素とヨウ素は反応してヨウ化水素を形成します。
* 逆反応: ヨウ化水素は、水素とヨウ素に分解します。
平衡の位置は、反応の条件(温度、圧力、濃度)に依存します。