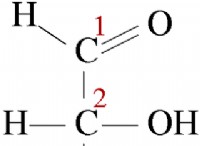
酸化ナトリウム(Na₂O):
* 層: ナトリウム(Na)は高度な電気依存症の金属であるため、電子を容易に失い、陽性イオン(Na⁺)を形成します。酸素(O)は非常に感動的であり、電子を獲得して負イオン(O²⁻)を形成します。ナトリウムと酸素が反応すると、イオン結合を介して酸化ナトリウム(Na₂O)を形成します。
* 水との反応: 酸化ナトリウムは水と激しく反応して、強い基部である水酸化ナトリウム(NaOH)を形成します。
na₂o +h₂o→2 naoh
* 基本的な性質: 水酸化ナトリウム(NAOH)は強力な塩基であり、溶液中の水酸化物イオン(OH⁻)を容易に放出します。これらの水酸化物イオンは、酸化ナトリウムの基本的な性質に関与しています。
酸化リン(P₄O₁₀):
* 層: リン(P)は、異なる酸化物を形成できる非金属であり、最も一般的なのは五酸化リン(P₄O₁₀)です。 リンは、酸素よりも電気陰性度が低く、酸化物の極性結合を引き起こします。
* 水との反応: 酸化リンは水と反応してリン酸(h₃po₄)を形成します。
p₄o₁₀ + 6H₂O→4H₃po₄
* 酸性の性質: リン酸は弱酸であるため、溶液中の水素イオン(h⁺)を部分的に放出します。これらの水素イオンは、酸化リンの酸性の性質に関与しています。
重要な概念:
* 電気陰性度: 原子が化学結合に電子を引き付ける傾向。
* イオン結合: 反対に帯電したイオン間の静電引力によって形成される化学結合の一種。
* 共有結合: 原子間の電子の共有によって形成される化学結合の一種。
* 酸: 溶液中の水素イオン(H⁺)を放出する化合物。
* ベース: 溶液中の水酸化物イオン(OH⁻)を放出する化合物。
要約: 酸化物の形成に関与する元素間の電気陰性度の違いは、酸化物が塩基性であるか酸性であるかを決定します。 高度な電気依存症のナトリウムと高感動性酸素によって形成される酸化ナトリウムは塩基性です。非金属リンと酸素によって形成される酸化リンは酸性です。