コア コンセプト
この有機化学のチュートリアルでは、ディールス アルダー反応の基礎を学びます。これには、その生成物と反応物の化学、そのメカニズム、その位置選択性、およびいくつかの重要な反応バリアントが含まれます。
ディールスアルダー反応物と生成物
Diels-Alder 反応では、2 つの小さな炭素構造から 6 炭素のシクロアルケンが形成されます。具体的には、2つの反応物はジエンとジエノフィルと呼ばれます。最も単純な Diels-Alder 反応では、1,3-ブタジエンとエテンを使用します。
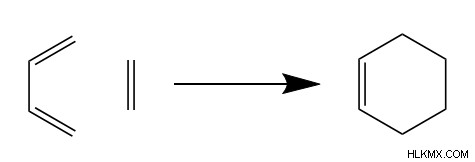
ジエンは、その 2 つの二重結合のために化学者によって呼ばれ、環状生成物に 6 つの炭素のうちの 4 つを供給します。興味深いことに、ジエンの 2 つの二重結合は、ジエノフィルと反応して共役するために互いにシスである必要があります。つまり、二重結合の pi 電子は協調して移動する必要があります。この協調運動は、後で説明するように、ディールス アルダーのメカニズムにおいて重要な役割を果たします。ジエンとの反応性からいわゆるジエノフィルは、生成物に 2 つの炭素を供給し、そのような炭素間に二重結合を持っています。
環状生成物構造を構成する6つの炭素に加えて、ジエンとジエノフィルは多数の異なる構造を持つことができ、それでもディールス・アルダー反応を受けます。実際、以下のシクロペンタジエンで示すように、分子はジエンとジエノフィルの両方として機能します。
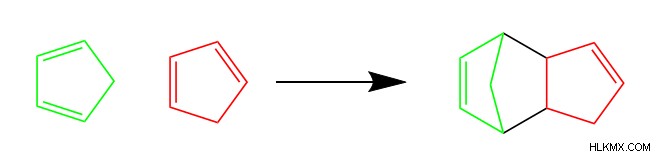
ディールス アルダー反応機構
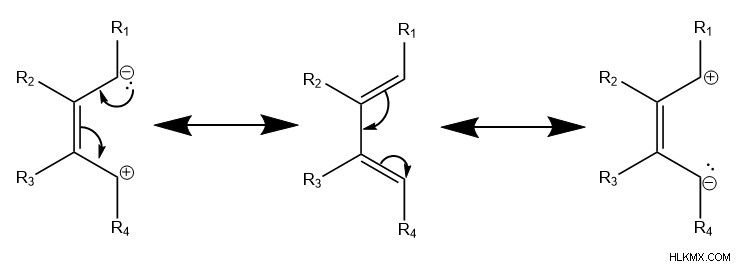
まず、ジエンとジエノフィルは、ジエノフィルの各炭素をジエンの炭素 1 と 4 に揃える特定の配向と相互作用する必要があります。次に、ベンゼンのような遷移状態が形成され、電子の円運動を伴い、反応物間に 2 つのシグマ結合が形成されます。また、ジエンの炭素2と3の間にパイ結合が形成されます。これにより、環状の 6 炭素生成物が得られます。
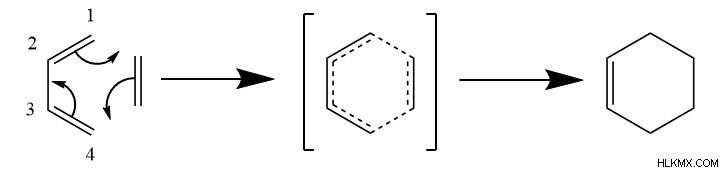
ご覧のとおり、反応により 2 つのパイ結合が壊れ、2 つのシグマ結合が形成されます。シグマ結合はパイ結合よりもエネルギーが低いため、これはディールス アルダー反応が発熱性であることを意味します。ただし、一般に、2 つの反応物から 1 つの生成物しか形成されないため、この反応はエントロピーに負の変化をもたらします。熱力学的に、これはエンタルピーがディールス アルダー反応を駆動することを意味します。
速度論的には、遷移状態の形成に必要な反応物の正確な位置により、ディールズ アルダー反応はゆっくりと進行する傾向があります。これにより、遷移状態形成のエントロピーが大幅にマイナスに変化します。
上に示したように、ディールスアルダーは酸触媒も塩基触媒も必要としないため、さまざまな非極端な pH 条件が反応に受け入れられることを意味します。
Diels-Alder 反応 位置選択性
上記の一般的なメカニズムは、一方の炭素がジエンの炭素 1 と結合し、もう一方の炭素が 4 と相互作用する限り、ジエノフィルはジエンに対していずれかの位置を持つことができることを意味します。これは、ジエンまたはジエノフィルのいずれかがメソである場合に当てはまります。化合物 (つまり、どちらかの反応物が対称である場合)
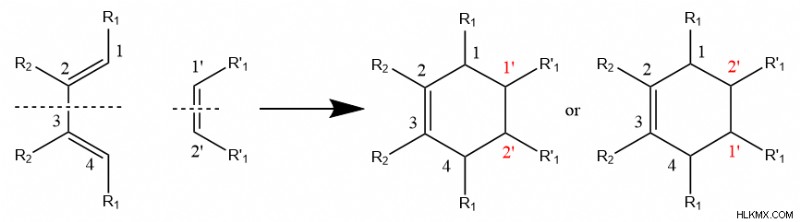
しかし、ジエンとジエノフィルの両方が対称性を欠いている場合、反応は、反応物の特定の領域が他の領域よりも高い反応性を有するため、ジエノフィルに対してジエンの特定の配向を支持します。化学者はこの現象を「位置選択性」と呼んでいます。
ジエンとジエノフィルの両方で、アミンのような電子が豊富な基またはカルボン酸のような電子が少ない基の配置は、分子の共鳴形式に影響を与えます。これらの共鳴形態は、分子の末端にある炭素に部分的な正または負の電荷を配置します。
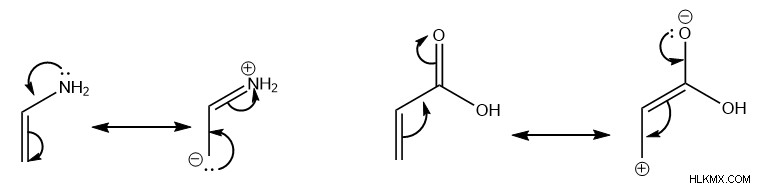

具体的には、分子の電子分布のこの変化が局所的な反応性に影響を与え、結果としてさまざまな生成物が優先されます。パイ電子が循環的に移動してディールス-アルダー反応を受けるのをより適切に可能にするために、ジエンからの部分的に正の炭素は、ジエノフィルのより多くの負の炭素とのシグマ結合の形成を支持し、その逆も同様です。
類似グループのディールス・アルダー
興味深いことに、両方の反応物に電子が豊富なグループまたは電子が少ないグループが 1 つずつある場合、反応は メタ を優先します。 製品。 メタ 、このコンテキストでは、グループが互いに 2 炭素離れていることを意味します。
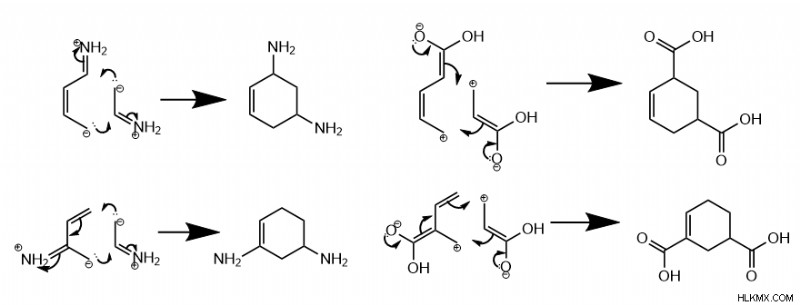
異なるグループのディールス・アルダー
さらに、一方の分子が電子豊富な基を持ち、もう一方の分子が電子不足の基を持つ場合、反応は para グループが反対に配置されている製品、または ortho グループが隣接して配置されている製品。 パラの形成 対直交 製品は、ジエン基が外部炭素 (1 または 4) または内部炭素 (2 または 3) のどちらにあるかによって異なります。
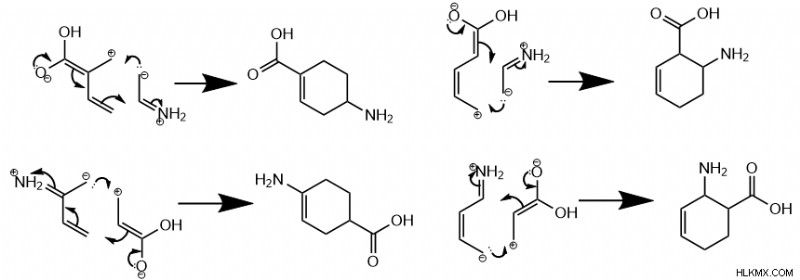
複数の結合基を持つジエンおよびジエノフィルの場合、ディールスアルダーの位置選択性は分子の共鳴形態に依存します。
代替ディールズ アルダー反応
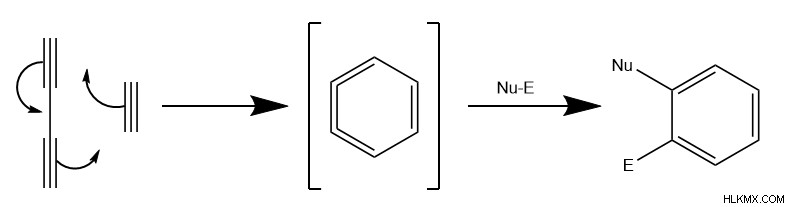
ディールス・アルダー反応が 1928 年にドイツの化学者オットー・ディールスとクルト・アルダーによって発見されて以来、そのメカニズムは後の化学者に用途が広いことが証明されました。その結果、後の化学者は、ディールス アルダーの多くの変種を記述し、実装しました。いくつかの例には、化学者がイミン-ディールス-アルダー (IDA) またはオキソ-ディールス-アルダー (ODA) 反応を使用して作る、環員として非炭素原子を持つ複素環式分子の形成が含まれます。

Hexadehydro-Diels-Alder 反応 (HDDA) は、反応分子が二重結合の代わりに三重結合を持つ別の一般的なバリアントを表します。このメカニズムは、化学者がベンザイン中間体と呼ぶものを形成する、電子の同じ周期的な動きに従います。次に、求核成分と求電子成分の両方を持つ化合物が、最終的な三重結合で付加反応を行います。その結果、HDDAは芳香族分子を形成する。ただし、メカニズムの分子構造が特殊であるため、反応にはしばしば遷移金属触媒が必要です。