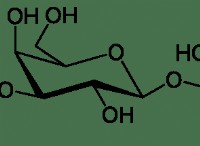
これが故障です:
* オクテットルール: ほとんどの原子は、最も外側のシェルに8つの電子を持つように努力しています(価数シェル)。これはOctetルールとして知られています。
* 例外: 一部の要素、特に第1期と第2期の要素は、外側のシェル(ヘリウムなど)に2つの電子のみがあるだけで安定しています。
* 獲得、負け、または共有: 安定性を達成するために、原子は次のとおりです。
* 電子ゲイン: 非金属は、外側のシェルを満たすために電子を獲得する傾向があります。
* 電子を失う: 金属は完全な内側のシェルを露出させるために電子を失う傾向があります。
* 電子を共有: これは、原子が完全な外側のシェルを達成するために電子を共有する共有結合で起こることです。
例:
* 塩素 外側のシェルに7つの電子があります。 8の完全な外殻を持つには、もう1つの電子が必要です。
* ナトリウム 外側のシェルに1つの電子があります。次の内側のシェルに8の完全な外側のシェルを持つために、この電子を簡単に失う可能性があります。
要約すると、原子の「希望」の電子の数は、外側のシェルを埋めて安定性を達成するために必要な数に基づいています。 これが、化学反応と分子の形成を促進するものです。