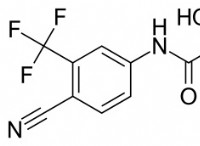
これがどのように機能しますか:
* ノーブルガス構成: 貴族は電子の完全な外側の殻を持っているため、非常に安定しているため、非相性はありません。
* 電子の共有: 一方、非金属には不完全な外殻があります。安定するために、彼らは他の非金属と電子を共有して共有結合を形成します。
* オクテットルール: 電子を共有することにより、非金属は効果的に外側の殻を「満たし」、貴族のそれと同様の安定した電子構成を達成します(多くの場合、オクテットの規則に従って8つの電子を持つ)。
例:
* 塩素(cl): 塩素には、外殻に7つの電子があります。 Argon(AR)のような安定した構成を実現するには、もう1つの電子が必要です。
* 塩素ガスの形成(Cl₂): 2つの塩素原子が最も外側の電子を互いに共有し、共有結合を形成します。現在、各塩素原子はその外殻に8つの電子を効果的に持っており、安定したオクテット構造を実現しています。
その他の例:
* 酸素(O): 酸素は、別の酸素原子と共有結合を形成して、O₂(酸素ガス)を形成します。
* 水(h₂o): 酸素は電子を2つの水素原子と共有して水を形成します。
要するに、非金属元素は、共有結合の他の非金属と電子を共有することにより、Nobleガスの構成を実現します。これにより、中立状態に存在するために必要な安定性を獲得できます。