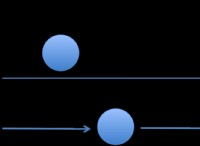
h =u + pv
エンタルピー自体は反応の自発性を直接決定しませんが、その変化(ΔH)は重要な役割を果たします。方法は次のとおりです。
1。発熱反応(ΔH<0):
* 周囲に熱を放出します。
* エンタルピーの面で好ましい 、システムがエネルギーを失い、より安定させます。
*ただし、常に自発的ではありません 、エントロピーのような他の要因がプロセスに影響を与える可能性があるため。
2。吸熱反応(ΔH> 0):
* 周囲から熱を吸収します。
* エンタルピーの点で好ましくない 、システムがエネルギーを獲得するにつれて、安定性が低下します。
* 通常は自発的ではありません 、続行するには外部エネルギー入力が必要です。
ギブス自由エネルギー(g):
自発性を正確に予測するには、ギブス自由エネルギー(g)を使用して、エンタルピー変化(ΔH)とエントロピー変化(ΔS)の両方を考慮する必要があります。
Δg=Δh -tΔS
* ΔS> 0: システムの障害またはランダム性の増加、一般的に好ましい。
* t: ケルビンの温度。
自発性とギブス自由エネルギー:
* Δg<0: 反応は、特定の条件下で自発的(好ましい)です。
* Δg> 0: 反応は、特定の条件下では非種子(不利な)です。
* Δg=0: 反応は平衡状態であり、そこでは前方速度と逆速度が等しくなります。
要約:
エンタルピーの変化だけでは、自発性を保証するものではありません。エンタルピーとエントロピーの両方を組み込んだギブスの自由エネルギーは、特定の条件下で反応が自発的に進行するかどうかの究極の指標です。