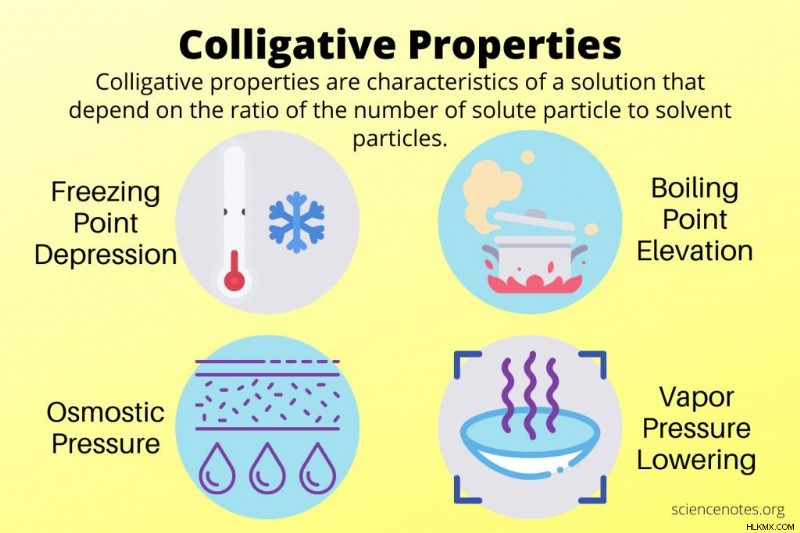
化学では、集合特性 は、溶質粒子の化学的同一性ではなく、溶媒粒子と比較した溶質粒子の数に依存する化学溶液の特性です。ただし、共同プロパティは行う 溶剤の性質によります。集合的な 4 つの特性は、凝固点降下、沸点上昇、蒸気圧降下、および浸透圧です。
集合プロパティはすべてのソリューションに適用されますが、それらを計算するために使用される方程式は、揮発性溶媒に溶解した不揮発性溶質の理想的なソリューションまたは弱いソリューションにのみ適用されます。揮発性溶質の集合特性を計算するには、より複雑な式が必要です。凝集特性の大きさは、溶質のモル質量に反比例します。
共同プロパティの仕組み
溶質を溶媒に溶解すると、溶媒分子間に余分な粒子が導入されます。これにより、単位体積あたりの溶媒濃度が低下し、本質的に溶媒が希釈されます。効果は、化学的性質ではなく、余分な粒子の数に依存します。たとえば、塩化ナトリウム (NaCl) を溶解すると 2 つの粒子 (1 つのナトリウム イオンと 1 つの塩化物イオン) が生成され、塩化カルシウム (CaCl
4 つの共同プロパティ
凝固点降下
溶液の凝固点は、純粋な溶媒の凝固点よりも低くなります。凝固点の低下は、溶質のモル濃度に正比例します。
砂糖、塩、アルコール、または化学薬品を水に溶かすと、水の凝固点が下がります。凝固点降下の例としては、氷に塩をまぶして溶かすことや、ウォッカを凍らせずに冷凍庫で冷やすことなどがあります。水以外の溶媒でも効果はありますが、温度変化量は溶媒によって異なります。
凝固点の式は次のとおりです。
ΔT =iK
どこ:
ΔT =温度変化 (°C)
i =ファントホッフ係数
K
m =mol 溶質/kg 溶媒での溶質のモル濃度
モル凝固点降下定数の表があります (K
| 溶媒 | 通常の凝固点 (C) | K |
| 酢酸 | 16.66 | 3.90 |
| ベンゼン | 5.53 | 5.12 |
| 樟脳 | 178.75 | 37.7 |
| 四塩化炭素 | -22.95 | 29.8 |
| シクロヘキサン | 6.54 | 20.0 |
| ナフタレン | 80.29 | 6.94 |
| 水 | 0 | 1.853 |
| p -キシレン | 13.26 | 4.3 |
沸点上昇
溶液の沸点は、純粋な溶媒の沸点よりも高くなります。凝固点降下と同様に、その効果は溶質のモル濃度に正比例します。たとえば、水に塩を加えると、沸騰する温度が上がります (それほど大きくはありませんが)。
沸点上昇は次の式から計算できます:
ΔT =K
ここで:
K
m =mol 溶質/kg 溶媒での溶質のモル濃度
エブリオスコピック定数または沸点上昇定数の表があります (K
| 溶媒 | 標準沸点 (C) | K |
| ベンゼン | 80.10 | 2.53 |
| 樟脳 | 207.42 | 5.611 |
| 二硫化炭素 | 46.23 | 2.35 |
| 四塩化炭素 | 76.75 | 4.48 |
| エチルエーテル | 34.55 | 1.824 |
| 水 | 100 | 0.515 |
蒸気圧の低下
液体の蒸気圧は、凝縮と気化が同じ速度で発生する (平衡状態にある) ときに、その蒸気相によって加えられる圧力です。溶液の蒸気圧は常に、純粋な溶媒の蒸気圧よりも低くなります。
これが機能する方法は、溶質イオンまたは分子が、環境にさらされる溶媒分子の表面積を減らすことです。そのため、溶媒の蒸発速度が低下します。凝縮速度は溶質の影響を受けないため、新しい平衡では気相の溶媒分子が少なくなります。エントロピーも役割を果たします。溶質粒子は溶媒分子を安定させ、安定化させて蒸発しにくくします。
Raoult の法則は、蒸気圧と溶液の成分の濃度との関係を説明しています。
PA =XA PA *
どこ:'
PA は、溶液の成分 A によって加えられる分圧です。
PA * は純Aの蒸気圧
XA A
不揮発性物質の場合、蒸気圧は溶媒のみによるものです。方程式は次のようになります。
Pソリューション =X溶媒 P溶媒 *
浸透圧
浸透圧は、溶媒が半透膜を横切って流れるのを止めるのに必要な圧力です。溶液の浸透圧は、溶質のモル濃度に比例します。したがって、溶媒に溶解する溶質が多いほど、溶液の浸透圧が高くなります。
van’t Hoff の式は、浸透圧と溶質濃度の関係を表しています。
Π =icRT
どこで
Πは浸透圧
i はファントホッフ指数
c は溶質のモル濃度
R は理想気体定数
T はケルビンの温度です
オストワルトと共同財産の歴史
化学者であり哲学者でもあるフリードリッヒ ヴィルヘルム オストヴァルトは、1891 年に集合的性質の概念を導入しました。「集合的」という言葉は、ラテン語の colligatus に由来します。 (「一緒に結合」)、溶媒特性が溶液中の溶質濃度に結合される方法を指します。オストワルドは、実際に溶質特性の 3 つのカテゴリを提案しました:
<オール>参考文献
- レイドラー、K.J.; Meiser、J.L. (1982)。 物理化学 .ベンジャミン/カミングス。 ISBN 978-0618123414.
- マッカリー、ドナルド。ら。 (2011)。 一般化学 .大学科学図書。 ISBN 978-1-89138-960-3.
- Tro, Nivaldo J. (2018). 化学:構造と特性 (第 2 版)。ピアソン教育。 ISBN 978-0-134-52822-9。