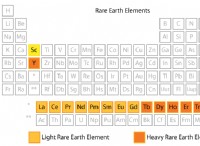
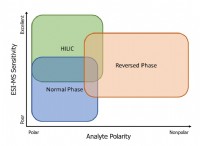
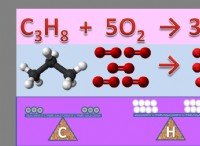
1。 極性溶質と極性溶媒(ように溶解するような)
* 例: 水に溶解した砂糖(溶質)(溶媒)
* 相互作用: 極性分子は不均一な電荷分布を持ち、正と負の端を生成します。水は非常に極性で、強い双極子のモーメントがあります。糖分子には極性ヒドロキシル基(-OH)があります。これらの反対の電荷は引き付けられ、溶質と溶媒の間に水素結合が形成されます。
* フィット: 極性溶質と溶媒分子は、ある分子の正の端が別の分子の負の端を引き付けると整列しています。これにより、強い魅力が生まれ、溶質粒子を溶媒内に均等に分散させることができます。
2。非極性溶質と非極性溶媒(ような溶解のような)
* 例: ガソリンに溶解したオイル(溶質)(溶媒)
* 相互作用: 非極性分子には均一な電荷分布があります。 それらは主に弱いファンデルワールスの力(ロンドン分散力)を介して相互作用します。
* フィット: 非極性溶質分子と溶媒分子は、同様の分子間力を共有するため、簡単に混合できます。分子は強い結合を形成しませんが、同様の魅力と反発特性のために混ざり合うことができます。
3。イオン溶質と極性溶媒
* 例: 塩(NaCl)は水に溶解しました
* 相互作用: イオン化合物は、荷電イオン(カチオンと陰イオン)で構成されています。水のような極性溶媒は強い双極子のモーメントを持ち、イオンを引き付けて囲み、それらを引き離し、結晶格子から分離することができます。このプロセスは水和と呼ばれます。
* フィット: 水分子の正の端が陰イオンを囲み、水分子の負の端が陽イオンを囲みます。イオンと極水分子の間の強い引力により、イオン化合物が溶解することができます。
4。 例外とより複雑なケース
* 溶解度: 溶質が溶媒に溶解する程度は、溶質分子と溶媒分子間の相互作用の強度に依存します。 時には、少量の非極性溶質が、弱い相互作用のために極性溶媒に溶解する可能性があります。
* 複雑な分子: 複数の官能基を持つより大きな分子は、極性領域と非極性領域の両方を持つことができます。それらの溶解度は、これらの相互作用のバランスによって決定されます。
要約:
溶質粒子と溶媒粒子が一緒に適合する方法は、極性とそれらが示す分子間力の種類に依存します。 「溶解するように」は一般的な経験則です。極性溶質は極性溶媒によく溶解し、非極性溶質は非極性溶媒によく溶解します。 イオン溶質は、しばしば強いイオン双極子相互作用を介して極性溶媒に溶解します。