化学式とは
化学式 化学反応を記号と数字で表します。化学式は、さまざまな反応物と生成物の相対モル量とアイデンティティを示します。化学式のバランスをとると、反応に関与する化合物の正確な比率を決定するのに役立ちます!
化学式の基礎
1.化学式の基本部分
化学式には、反応物、生成物、「収率」矢印の 3 つの基本部分があります。
| 反応物 | 収量 | 製品 | |
| 定義 | 反応物は、反応に必要で、反応中に化学変化を受ける化合物または元素です。 | 反応において、「収量」は「生成する」または「形成する」ことを意味し、通常は矢印で表されます。反応物が化学変化を起こすと、生じる 製品。 | 生成物は、化学反応で生成される最終結果または化合物です。 |
| 例 | CH4 (g) + 2O2 (g) | → | CO2 (g) + 2H2 O (g) |
反応物と生成物は、一緒に追加された複数の分子としてリストされます。これは、あらゆる化学式に当てはまります。ただし、降伏矢印にはいくつかの異なるスタイルがあります。
- 前方矢印 (→) は一般的な反応を示します。
- 平衡矢印 (⇌) は可逆プロセスを示します。
- 共鳴矢印 (↔) は、2 つ以上の種が互いに共鳴構造であることを示します。
- 理論上の矢印 (⇢) は、理論的なプロセスを示しています。
- 逆合成の矢印 (⇒) は、反応物から生成物に至る潜在的な方法を示しています。
2.化学式の数字
化学式には、添字と係数の 2 種類の数値があります。 下付き 分子内に各元素の原子がいくつあるかを表します。 係数 反応中に存在する特定の化合物の分子数を表します。 平衡方程式で変更できるのは分子の係数のみです。
下付き文字が含まれる分子 同じ要素の原子の違い (たとえば、H2 O 対 H2 O2 ) は化学組成が異なります。つまり、同じ化合物ではありません。このため、化学式のバランスをとる場合、分子の添え字は変更できません。 異なる係数を持つ同じ分子 (たとえば、2H2 Oと5H2 O) は同じ化合物ですが、異なる量で存在します。
分子中 3NO2 、係数は 3 です (NO2 の 3 つの分子があります) )、酸素の添え字は 2 です (1 分子の NO2 には 2 つの酸素原子があります)。 )。全部で 6 個の酸素原子があります (3 分子の NO2 NO2 1分子あたり2個の酸素原子 .)
係数 各分子または化合物の相対を表します 反応中の元素のモル数または分子数。これらは相対量であるため、数値は比率として解釈することもできます。上記の例では、比率は 1 CH4 になります。 :2O2 :1 CO2 :2H2 O. 比率が一定である限り、式は任意の比例係数 (2:4:2:4、3:6:3:6 など) で正しく書き直すことができますが、使用するのが一般的です。 最小の整数係数 .
3.質量保存の法則
質量保存の法則は、物質 (または原子) が化学反応で生成も破壊もされないことを示しています。これは、化学反応が起こる前と後に、各化合物が等量存在しなければならないことを意味します。この法則は化学式のバランスに適用されます。これは、式の両側にある各化合物の相対量が同じでなければならないためです。
以下は、メタンが空気中で燃焼して二酸化炭素と水蒸気を生成する反応の例です:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2 O (g)
ご覧のとおり、式の両側にはそれぞれ炭素原子 1 個、水素原子 4 個、酸素原子 4 個があります。したがって、方程式はバランスが取れています。
化学式の作成とバランス調整の手順
<オール>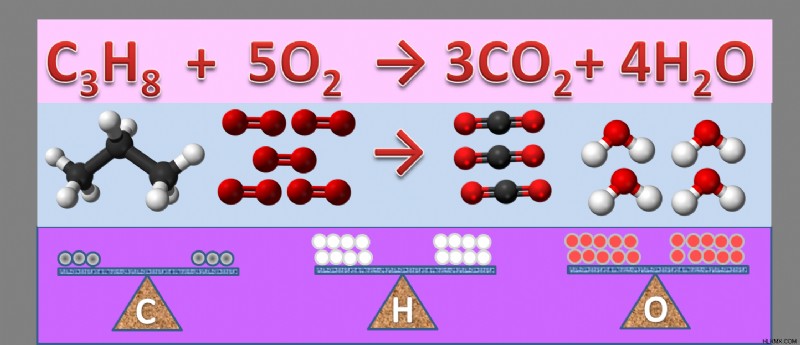
化学式のバランス – 例
反応のバランス:メタンは空気中で燃焼し、酸素と結合して二酸化炭素と水蒸気を生成します
1.数式を書く
反応を言葉の方程式として書きます:メタン + 酸素 → 二酸化炭素 + 水
2.単語の方程式を公式方程式に書き換える
公式方程式として書き換え:CH4 (g) + O2 (g) → CO2 (g) + H2 O (g)
3.質量保存の法則を使用して式のバランスをとります。
<オール>4.すべての原子を数えて平衡方程式を確認してください。
| 左側 | 右側 |
| 炭素原子 – 1 (CH4 ) | 炭素原子 – 1 (CO2 ) |
| 水素原子 – 4 (CH4 ) | 水素原子 – 4 (2H2 O) |
| 酸素原子 – 4 (2O2 ) | 酸素原子 – 4 (CO2 から 2 つ) , 2H 2 から 2 O) |
さらに読む
- 正味のイオン方程式の書き方
- レドックス反応のバランスをとる
- 化学反応の種類
- 反応物の制限







