分子化合物
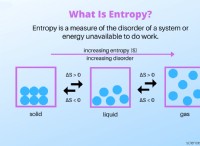
* 融点と沸点の低い: 分子化合物は、一般に、イオン化合物よりもはるかに低い融点と沸点を持っています。
* 分子間力の弱い: 分子を一緒に保持する力は比較的弱いです。これらの力は、分子間力(ファンデルワールスの力、水素結合、または双極子双極子相互作用など)と呼ばれます。 これらの力を克服し、分子を分解するためには、より少ないエネルギーが必要です。
* 共有結合: 分子化合物は、原子が電子を共有する共有結合によって結合されます。これらの結合は分子自体の中で強力ですが、分子間の魅力は弱いです。
イオン化合物
* より高い融点と沸点: イオン化合物は、融点と沸点がはるかに高くなっています。これは、結晶格子にイオンを一緒に保持する強い静電力によるものです。
* 強力な静電力: イオン化合物中の反対に帯電したイオンは、互いに強く引き付けます。 これらの強力な力を克服し、イオンを分離するには、かなりの量のエネルギーが必要です。
* イオン結合: イオン化合物は、原子が電子を伝達するときに形成され、正に負に帯電したイオンを生成します。これらのイオンは、高度に秩序化された3次元格子構造に配置されています。
ここに簡単なアナロジーがあります:
大理石の山(分子化合物)を想像してください。ビー玉は弱い力によって一緒に保持されます。少しの努力で簡単に分離することができます(融点が低いと沸点)。
磁石のしっかりと詰められた箱(イオン化合物)を想像してください。磁石は強い力で互いに引き付けられます。それらを分離するにははるかに多くの力が必要です(溶融ポイントと沸点が高い)。
例外:
* ネットワーク共有化合物: ダイヤモンドやクォーツなどの一部の分子化合物は、非常に高い融点を持っています。これは、構造全体の連続ネットワークに拡張される強力な共有結合があるためです。
* 極性: 強い水素結合(水など)を持つ極性分子化合物は、非極性分子と比較して、融点と沸点が高い可能性があります。
キーテイクアウト:
粒子(分子またはイオン)を保持する力の強度は、物質の状態を変えるために必要なエネルギーの量を決定します。より強力な力(イオン結合など)は、より高い融点と沸点を意味しますが、より弱い力(分子間力など)は融点と沸点の低いことを意味します。