コア コンセプト
この記事では、シグマ結合とパイ結合の基本と、有機化学におけるそれらの重要性について学びます。また、いくつかの実用的な例を使用して、知っていることを適用する機会もあります。
他の記事で取り上げるトピック
- 量子数と軌道形状
- パウリ排除原則
- アウフバウ原則
- フンドの法則
- ニューマン プロジェクション
シグマ ボンドとパイ ボンドの基本
シグマ結合とパイ結合は、二重結合と三重結合の存在を説明する原子価結合理論と分子軌道理論の一側面です。まず、シグマ (σ) とパイ (π) の両方の結合について説明する必要があります。シグマ結合は、各原子のエネルギーが最も高い利用可能な軌道が互いに重なり合うときに形成されます。したがって、建設的な相互作用は、2 つの原子核間で共有されるより高い電子密度を持つ 2 つの原子間のシグマ結合の形成につながります。

2つの原子間の追加の結合は、パイ結合の形成で説明されます。これは、それぞれの原子のハイブリダイズしていない (満たされた) p 軌道が重なり合い、確立されたシグマ結合の外側の 2 つの原子間でより高い電子密度を形成する場合に発生します。この結合は、反結合軌道も作成します。この軌道が満たされると、2 つの原子間の結合が切れます。したがって、結論として、原子間の単結合にはシグマ結合があります。 2 つの原子間の追加の結合はパイ結合です。二重結合には 1 つのシグマ結合と 1 つのパイ結合があり、三重結合には 1 つのシグマ結合と 2 つのパイ結合があります。二原子窒素のような分子を参照すると、N
パイ結合と回転異性体
お気づきかもしれませんが、パイ結合は結合した電子雲を形成し、2 つの原子核の間の軸から少しずれています。これは、パイ結合を持つ問題の分子に重要な影響を与えます。
具体的には、単結合は 2 つの原子核の軸の周りを自由に回転できます。これは、単結合の各原子が互いに独立して回転できることを意味します。単結合は、軸に沿って 2 つの核を正確に接続する 1 つの結合 (シグマ結合) しか持たないため、これが可能になります。化学者は、これらの原子が互いに持つことができるさまざまな方向を回転異性体と呼び、有機化学において非常に重要です。多くの場合、このローテーションは非常に急速に発生します。たとえば、エタンはその C-C 結合を 1 秒間に 10 回完全に回転します。
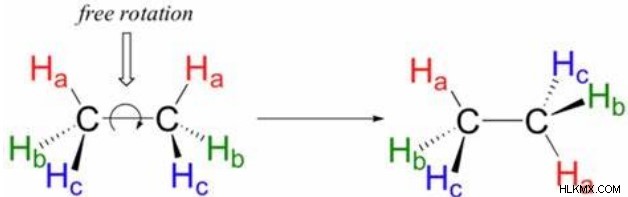
ただし、2 つの原子間に pi 結合が形成されると、すべての自由回転が停止します。パイ電子雲の変位により、原子間の配向の変化により、軌道の重なりが減少します。これは、パイ結合に参加している原子に結合している基が一定の相対的な向きを持っていることを意味します。考えられるさまざまな方向 (パイ結合形成前) は「回転異性体」とも呼ばれますが、「幾何異性体」という名前で呼ばれることもあります。
第4の絆?
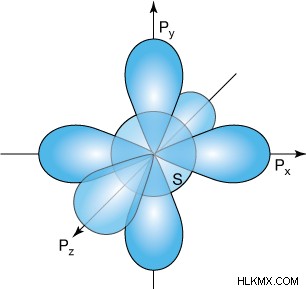
ハイブリダイズしていない満たされた p 軌道の重なりは、π 結合を形成します。それらの配向は、最初のシグマ結合に対して直交しており、多少ずれており、他の原子の p 軌道に対して平行であることに注意することが重要です。自由に回転できる通常のシグマ結合とは異なり、パイ結合を追加すると結合が回転しなくなります。写真からわかるように、3 p 軌道のうち 2 つだけが σ 結合に垂直になります。これは、p軌道の3番目が特定のシグマ結合に平行であることを意味し、したがって、原子は四重結合を形成するためにd軌道を呼び出す必要があります.さらに、二重結合を中心に原子を回転させるには、最初にパイ結合を切断する必要があります。
練習:シグマ結合とパイ結合の数を決定してください。
1:エチンにはσ結合とπ結合がいくつあるか?

2:グルコースには σ 結合と π 結合がいくつありますか?
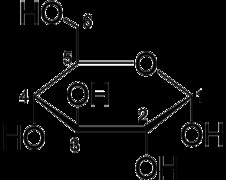
3:サリチル酸には σ 結合と π 結合がいくつありますか?

答え:
1:エチンは 3 つの σ 結合と 2 つの π 結合を形成します
2:グルコースは 29 個の σ 結合を形成する
3:サリチル酸は 12 個の σ 結合と 4 個の π 結合を形成します