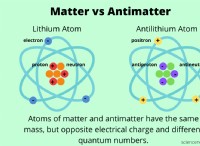
1。 XEは、希ガスの間で最大の原子半径と最低イオン化エネルギーを持っています:
* 原子半径: Xeの大きいサイズは、その外側の電子が核から遠くにあることを意味し、魅力が弱いことを意味します。これにより、削除が容易になり、結合が促進されます。
* イオン化エネルギー: 低いイオン化エネルギーは、xeが陽イオンを容易に失い、陽イオンを形成することを意味します。 これは、化合物を形成する能力の重要な要素です。
2。 Xeの価数シェルは、他の非金属に比較的エネルギーがあります:
* Xeの価電子のエネルギーレベルは、酸素やフッ素のような非常に感動性の高い要素のエネルギーレベルに近いものです。 これにより、安定した化学結合の形成が可能になります。
3。 Xe化合物の初期の発見:
* 1962年のニール・バートレットのXeptf6の画期的な発見は、Xeが化合物を形成する可能性を示し、さらなる研究への道を開いた。
他の貴族がより少ない化合物を形成する理由:
* より小さな原子半径: 彼、NE、およびARは、他の原子と効果的に相互作用するには小さすぎます。
* より高いイオン化エネルギー: これらの小さな希ガスから電子を除去するのははるかに困難です。
* 分極可能な電子雲が少ない: He、Ne、およびARの電子雲は容易に歪んでいるため、結合を形成する可能性が低くなります。
要約:
Xeの比較的大きな原子半径、低イオン化エネルギー、および他の非金属にエネルギーに近い価の原子価の独自の組み合わせにより、他のNobleガスと比較して、より幅広い種類の化合物を形成することができます。