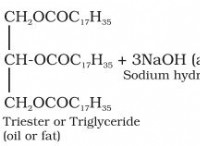2 na(s) + 2h₂o(l)→2 naoh(aq) +h₂(g)
各部分が表すものは次のとおりです。
* 2 Na(s): 固体ナトリウム(NA)の2つのモル
* 2h₂o(l): 液体水の2つのモル(H₂O)
* 2 naoh(aq): 水酸化ナトリウム水酸ナトリウム(NaOH)の2つのモル
* h₂(g): 1モルの気体水素(H₂)
説明:
* 反応物: ナトリウム(NA)は非常に反応性の高いアルカリ金属です。水と接触すると、激しい反応が発生します。
* 製品: この反応は、強力な塩基である水酸化ナトリウム(NAOH)と水素ガス(H₂)を生成します。
* バランス: 反応物側の各元素の原子の数が、製品側のその要素の原子の数に等しいため、方程式はバランスが取れています。
重要な注意: この反応は非常に発熱性であり、かなりの量の熱を放出します。生成された水素ガスは可燃性であるため、この反応を非常に注意して処理することが不可欠です。