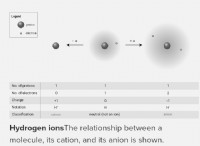
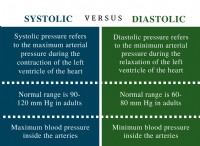
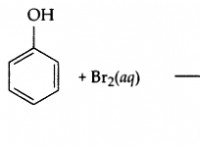
その理由は次のとおりです。
* イオン化合物: NAIはイオン化合物であり、積極的に帯電したナトリウムイオン(Na+)と負に帯電したヨウ化イオン(I-)で構成されています。
* 極性溶媒: 水(H2O)は極性溶媒です。つまり、電子の不均一な共有により、正と負の端があります。
* アトラクション: 水分子の正の末端はヨウ化物イオンを陰性に引き付け、水分子の負の端は正のナトリウムイオンを引き付けます。この強い魅力は、ナイクリスタルを一緒に保持する力を克服し、水に容易に溶解することを可能にします。
定量データ:
*室温(25°C)では、水中のNAIの溶解度は約100 mlあたり184グラムです 。これは、水自体の重量と比較して、水にNAIの重量のほぼ2倍を溶解できることを意味します。
*溶解度は温度とともに大幅に増加します。
注: 溶解度は動的なプロセスであり、水に溶けることができるNAIの最大量は、温度、圧力、他の溶質の存在などの要因に依存していることを覚えておくことが重要です。