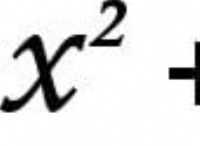これがバランスの取れた化学式です:
ba(s) + 2agc2h3o2(aq)→ba(c2h3o2)2(aq) + 2ag(s)
これが何が起こるかの内訳です:
* バリウム(BA) 高度に反応性のある金属であり、銀よりも反応性が高くなっています。
* 酢酸銀(AGC2H3O2) 可溶性イオン化合物であり、溶液中のイオン(Ag+およびC2H3O2-)に解離することを意味します。
*バリウムが加えられると、溶液から銀イオンを変位させ、酢酸バリウムを形成します。
*これは、バリウムが銀と比較して電子を失い、陽性イオン(Ba2+)を形成する傾向が高いためです。
*反応は、溶液から沈殿する固体銀金属の形成をもたらします。
観測:
* a 灰色がかった白い沈殿物の形成を観察する (シルバーメタル)溶液中。
*酢酸バリウムが存在するため、溶液はわずかに曇りになる可能性がありますが、これも可溶性ですが、わずかな乳白色の外観を持っている可能性があります。
*少量の水素ガスが放出されるため、反応が進行するにつれて、泡立ちまたは泡立ちがあるかもしれません。
重要な注意: この反応は非常に発熱性であり、活発になる可能性があります。この反応を注意して適切な安全対策を講じて実行することが重要です。