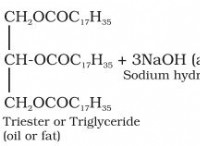酸化ナトリウム(Na₂O)および水
* 反応: 酸化ナトリウムは水と激しく反応して水酸化ナトリウム(NAOH)を形成します。
na₂o +h₂o→2naoh
* naohは強力な基盤です: 水酸化ナトリウムは水中で完全に解離し、水酸化物イオン(OH⁻)を放出し、溶液を高度にアルカリ性にし、pHが高い。
酸化カルシウム(CAO)および水
* 反応: 酸化カルシウムは水と反応して水酸化カルシウム(Ca(OH)₂)を形成します。
CaO +H₂O→CA(OH)₂
* ca(OH)₂は強いベースですが、可溶性が少ない: 水酸化カルシウムも強力な塩基であるため、水酸化物イオン(OH⁻)を溶液に放出します。ただし、水酸化ナトリウムよりも水に溶けやすいです。これは、Ca(OH)が少なく溶解し、同様の溶液でNaOHと比較してOHイオンが少ないことを意味します。
酸化ナトリウム溶液のpH が高い理由
酸化ナトリウム溶液のより高いpHは以下によるものです。
* oh⁻:の高濃度 水酸化ナトリウムはより溶けやすいため、溶液中の水酸化物イオンの濃度が高くなり、溶液がよりアルカリ性になります。
* より強いベース: 水酸化ナトリウムと水酸化カルシウムはどちらも強い塩基ですが、溶解度の違いは水酸化物イオン濃度に大きく影響します。
要約: 酸化ナトリウムと酸化カルシウムの両方が水と反応して強い塩基を形成しますが、水酸化ナトリウムの溶解度が高いほど、水酸化水素イオンの濃度が高くなり、酸化カルシウム溶液と比較してpHが高くなります。