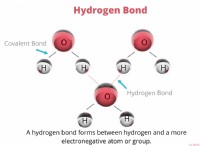
反応:
弱酸であるクエン酸は、亜鉛金属と反応して、水素ガス(H₂)、クエン酸亜鉛、および水を生成します。
化学式:
3zn(s) +2c₆h₈o₇(aq)→3znc₆h₅o₇(aq) +3h₂(g)
説明:
* 亜鉛(Zn): 亜鉛は、酸化できる反応性金属です。
* citric酸(c₆h₈o₇): クエン酸は酸として機能し、反応に水素イオン(H+)を提供します。
* 水素ガス(H₂): 水素ガスは、反応の副産物として生成されます。
* クエン酸亜鉛(Znc₆h₅o₇): クエン酸亜鉛は、溶液中の可溶性塩として形成されます。
反応に影響する要因:
* 温度: より高い温度は一般に反応速度を上昇させます。
* クエン酸の濃度: クエン酸の濃度が高くなると、より速い反応が生じます。
* 亜鉛の表面積: 亜鉛の表面積が大きくなると、反応速度が増加します。
観測:
*亜鉛金属の表面に水素ガスの小さな泡の形成を観察することができます。
*クエン酸亜鉛が形成されると、ソリューションはわずかに曇りになる可能性があります。
*反応は、塩酸(HCl)のような強い酸との亜鉛の反応ほど活発ではありません。
安全性:
*反応は、可燃性の水素ガスを生成します。実験中に適切な換気を確保してください。
*安全ゴーグルと手袋を着用して、目と肌を保護します。
アプリケーション:
*亜鉛とクエン酸の反応は、一部の自家製の洗浄ソリューションで、またバッテリー式の成分として使用されます。
注: この反応は、亜鉛と強い酸との反応ほど一般的でも活発でもありません。反応速度は、亜鉛の純度とクエン酸溶液の濃度にも影響されます。