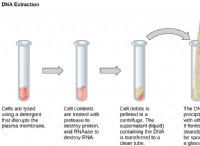
* 水は極性共有化合物です: 水(H₂O)は、水素と酸素原子の間の共有結合によって形成されます。 これらの結合の電子は均等に共有されておらず、水素原子の部分的な正電荷と酸素原子に部分的な負電荷をもたらします。これにより、水は極分子になります。
* 水はイオン共有化合物と極性化合物の両方を溶解できます: 水の極性により、イオン化合物と極性共有化合物の両方と強く相互作用することができます。
* イオン化合物: 水の部分電荷は、反対に帯電したイオンを結晶格子に引き付け、格子を分解し、化合物を溶解します。
* 極性共有化合物: 水は他の極性分子と水素結合を形成し、それらの溶解につながる可能性があります。
* 水は、いくつかの非極性化合物を限られた範囲で溶解することもできます: 水は主に極性およびイオン化合物にとって優れた溶媒ですが、いくつかの非極性分子をわずかに溶解することもできます。これは、水分子と非極性分子の間のファンデルワールスの力によるものです。
要約: 水は極性のために強力な溶媒であり、イオン共有化合物と極性の両方の共有化合物を効果的に溶解することができます。その主な役割は、これらのタイプの化合物を溶解することですが、いくつかの非極性化合物を溶解することもできます。