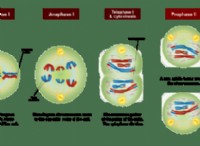
酸 水素イオン(H+)を溶液に寄付する物質です。酸を水に溶けると、H+イオンが放出され、溶液中のH+の濃度が増加します。これにより、がより酸性になります 。
ベース 溶液から水素イオン(H+)を受け入れる物質です。塩基が水に溶けると、溶液からH+イオンを除去し、溶液中のH+の濃度を減少させます。これにより、溶液が酸性度が低くなります(より塩基性またはアルカリ性) 。
ここにいくつかの例があります:
* 酸: 塩酸(HCl)、硫酸(H2SO4)、酢酸(CH3COOH)
* ベース: 水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、アンモニア(NH3)
pHスケール 溶液の酸性度またはアルカリ度を測定するために使用されます。 7のpHはニュートラルで、7未満は酸性であり、7以上は塩基性(アルカリ)です。
水素イオンを寄付または受け入れる酸と塩基の能力は、以下を含む多くの化学反応とプロセスの基礎です。
* 中和反応: 酸とベースが反応すると、それらは互いに中和し、水(H2O)と塩を形成します。
* バッファシステム: 生物学的系は、安定したpHを維持するために緩衝液を使用します。バッファーは、少量の酸または塩基が追加されると、pHの変化に抵抗する溶液です。
* 酸ベース滴定: 未知の酸または塩基の濃度を決定するために使用される方法。
要約すると、酸と塩基 溶液中の水素イオンの濃度を変化させる可能性のある物質であり、より酸性または塩基性にします。 pHのこれらの変化は、さまざまな化学反応と生物学的プロセスに大きな意味を持ちます。