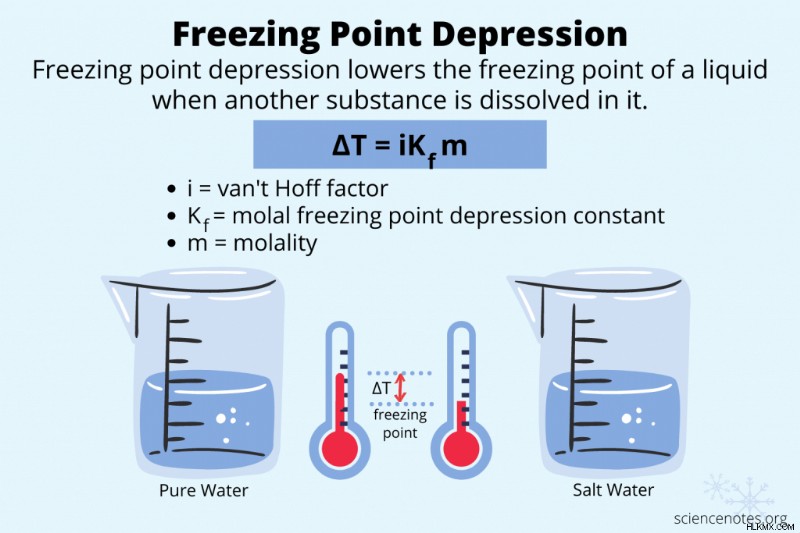
凝固点降下とは、液体に別の物質を溶かして凝固点の温度を下げることです。沸点上昇や浸透圧と同様に、これは物質の結合特性です。
凝固点降下の仕組み
これが意味することは、凝固点降下の量は、それらの化学的性質ではなく、液体に溶解する粒子の数に依存するということです.したがって、水に塩 (NaCl) を溶解することによる凝固点降下は、水に砂糖を溶解することによる効果 (C12) よりも大きくなります。 H22 O11 ) 各塩分子は 2 つの粒子 (Na および Cl イオン) に解離するため、砂糖は溶解しますが解離しません。塩化カルシウム (CaCl2) は、水中で 3 つの粒子 (1 つの Ca イオンと 2 つの Cl イオン) に解離するため、食塩よりも凝固点を下げます。
一般に、電解質は非電解質よりも大きな凝固点降下を引き起こします。ただし、溶媒への溶解性も重要です。したがって、塩 (NaCl) は、フッ化マグネシウム (MgF2) よりも水の凝固点を大きく低下させます。 )。フッ化マグネシウムは 3 つの粒子に解離し、塩は 3 つの粒子に解離しますが、フッ化マグネシウムは水に溶けません。
粒子の数が違いを生む理由は、これらの粒子が溶媒分子の間に入り込み、液体を凍結または凝固させる組織と結合の形成を乱すためです。
凝固点降下の例
凝固点降下は日常生活の中で起こります。以下にいくつかの例を示します。
- 海水の凝固点は純粋な水の凝固点よりも低いです。海水には多くの溶解塩が含まれています。この結果として、気温が 0 °C を下回る冬に川や湖がしばしば凍結します。海が凍るには、もっと低い気温が必要です。
- 凍った散歩に塩をかけると、凝固点降下により、溶けた氷が再凍結するのを防ぎます。
- 氷水に塩を加えると温度が下がり、冷凍庫がなくてもアイスクリームを作ることができます。あなたがすることは、アイスクリーム混合物の密封された袋を、塩漬けの氷のボウルに入れることだけです.
- 不凍液は水の氷点を下げ、冬に車内で水が凍るのを防ぎます。
- ウォッカやその他の高アルコール飲料は、家庭用冷凍庫では凍りません。アルコールは水の凝固点を著しく低下させます。ただし、ウォッカの凝固点は純粋なアルコールの凝固点よりも高くなります。したがって、凝固点降下の計算では、溶質 (エタノール) ではなく、溶媒 (水) の凝固点に注意してください!
凝固点うつ病フォーミュラ
凝固点降下の式は、クラウジウス-クラペイロンの式とラウールの法則を使用します。希薄な理想溶液の場合、凝固点降下の式はブラグデンの法則と呼ばれます:
ΔTf =iK
- ΔTf 通常の凝固点と新しい凝固点の温度差です
- i は、溶質が分解する粒子の数であるファントホッフ係数です
- Kf はモル凝固点降下定数または低温定数です
- m は溶液のモル濃度です
低温定数は、溶質ではなく、溶媒の特性です。この表には、K
| 複合 | 凝固点 (°C) | K |
|---|---|---|
| 酢酸 | 16.6 | 3.90 |
| ベンゼン | 5.5 | 5.12 |
| 樟脳 | 179.8 | 39.7 |
| 二硫化炭素 | -112 | 3.8 |
| 四塩化炭素 | -23 | 30 |
| クロロホルム | -63.5 | 4.68 |
| シクロヘキサン | 6.4 | 20.2 |
| エタノール | -114.6 | 1.99 |
| エチルエーテル | -116.2 | 1.79 |
| ナフタレン | 80.2 | 6.9 |
| フェノール | 41 | 7.27 |
| 水 | 0 | 1.86 |
凝固点降下の計算方法 – 問題例
凝固点降下式は、溶質が溶媒よりもはるかに少ない量で存在し、溶質が不揮発性である希薄な溶液でのみ機能することに注意してください.
例 #1
濃度 0.25 m の NaCl 水溶液の凝固点は何度ですか?水の Kf は 1.86 °C/m です。
この場合、塩は水中で 2 つのイオンに解離するため、i は 2 です。
ΔT =iK
したがって、これは、溶液の凝固点が水の通常の凝固点 (0 °C) よりも 0.93 度低いことを意味します。新しい凝固点は 0 – 0.93 =-0.93 °C です。
例 #2
31.65 グラムの塩化ナトリウム (NaCl) が 220.0 mL の水に 35 °C で溶解するときの水の凝固点は?塩化ナトリウムが完全に溶解し、35 °C での水の密度が 0.994 g/mL であると仮定します。 K
まず、塩水のモル濃度(m)を求めます。モル濃度は、水 1 キログラムあたりの NaCl のモル数です。
周期表から、元素の原子質量を見つけます:
原子質量 Na =22.99
原子量 Cl =35.45
NaCl のモル数 =31.65 g x 1 mol/(22.99 + 35.45)
NaCl のモル数 =31.65 g x 1 mol/58.44 g
NaCl のモル =0.542 mol
kg 水 =密度 x 体積
kg 水 =0.994 g/mL x 220 mL x 1 kg/1000 g
kg 水 =0.219 kg
mNaCl =NaCl のモル数/kg 水
mNaCl =0.542mol/0.219kg
mNaCl =2.477 モル/kg
次に、ファントホッフ係数を決定します。砂糖のように解離しない物質の場合、ファントホッフ係数は 1 です。塩は Na と Cl の 2 つのイオンに解離します。したがって、ヴァント ホフ係数 i は 2 です。
これで、すべての情報が得られ、ΔT を計算できます。
ΔT =iK
ΔT =2 x 1.86 °C kg/mol x 2.477 mol/kg
ΔT =9.21℃
31.65 g の NaCl を 220.0 mL の水に加えると、凝固点が 9.21 °C 下がります。水の通常の凝固点は 0 °C であるため、新しい凝固点は 0 – 9.21 または -9.21 °C です。
例 #3
62.2 グラムのトルエン (C7) を溶かしたときの凝固点降下は? H8 ) 481 グラムのナフタレンで?凝固点降下定数 K
まず、溶液のモル濃度を計算します。トルエンはイオンに解離しない有機溶質であるため、モル濃度はモル濃度と同じです。
m =62.2 g / 92.1402 g/モル =0.675058 m
トルエンは解離しないため、ファントホッフ係数は 1 です。
ΔT =iK
したがって、凝固点降下は 9.82 度です。これは凝固点が下がる量であり、新しい凝固点ではないことに注意してください。
参考文献
- アトキンス、ピーター (2006)。 アトキンスの物理化学 .オックスフォード大学出版局。 ISBN 0198700725.
- エイルワード、ゴードン。フィンドレイ、トリスタン (2002)。 SI 化学データ (第5版)。スウェーデン:ジョン・ワイリー&サンズ。 ISBN 0-470-80044-5.
- Ge, Xinlei;王西東(2009)。 「電解液の凝固点降下、沸点上昇、および蒸発エンタルピーの推定」。 工業および工学化学研究 . 48 (10):5123. doi:10.1021/ie900434h
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学 (第8版)。プレンティスホール。 ISBN 0-13-014329-4.