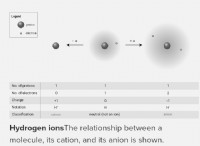
その理由は次のとおりです。
* 化合物 固定比の2つ以上の要素の組み合わせによって形成されます。
* イオン化合物 正の帯電イオン(陽イオン)と負に帯電したイオン(アニオン)の間の静電的引力によって形成されます。
* 共有化合物 原子間の電子の共有によって形成されます。
どちらの場合も、化合物の全体的な電荷は中性でなければなりません。これは、正と負の電荷のバランスを完全に意味することを意味します。
例えば:
* naCl(塩化ナトリウム) :ナトリウム(Na +)には+1電荷があり、塩素(Cl-)には-1電荷があります。料金のバランスを取り、フォーミュラユニットゼロの全体的な充電を行います。
* h₂o(水) :これは共有化合物であり、水素(H)と酸素(O)の間の電子の共有は中性分子をもたらします。
化合物内の個々のイオンの電荷はゼロではないことに注意することが重要です。ただし、フォーミュラユニットのすべての料金の合計は常にゼロに等しくなります。