フントの法則とは?
フントの最大多重度の規則は、最も一般的にはフントの規則と呼ばれ、サブレベル内のすべての原子軌道は、二重に占有される前に単一に占有されていると述べています。 すべての単独占有軌道は同じスピンを持つ電子を持っている .電子は、同じ軌道で別の電子と対になる前に、常に自身の副軌道を占有します。
この規則は、電子配置と分子軌道図の両方を作成するときに役立ちます。
実際のフントの法則
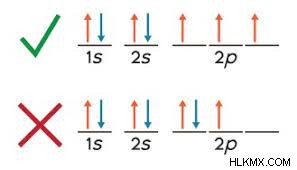
正しい使い方
フントの法則を使用するときに犯す最も一般的な間違いは、必要になる前に電子を二重にペアリングすることです。 p 軌道に記入するときは、各副軌道に電子が 1 つあるまで、電子を対にしないでください。すべての軌道に単一の電子が含まれたら、それらを反対のスピンの電子とペアにします。これも左から始めます。すべての電子が計算されたら、構成は完了です!
電子配置の例:窒素
窒素のボックス電子図の例を見てみましょう:
| N |  1 秒 1 秒 |  2 秒 2 秒 |    |
窒素には 7 個の電子があり、その電子配置は 1s2 2s2 2p3 であることがわかっています。 1s ボックスは 2s の前にいっぱいになる必要があり、2s は 2p の前にいっぱいになる必要があります。 1s と 2s の両方を満たした後、利用可能な 7 つの電子のうち 4 つを使用し、残りの 3 つを 2p 軌道に使用しました。
次に、フントの法則を適用する必要があります。電子は、同じ軌道で別の電子とペアになる前に、常に自分の準軌道を占有します。したがって、2p軌道の各電子は独自のボックスを取得し、スピンペアリングの必要はありません.また、それらはすべて同じ方向に回転します。
電子配置の例:酸素
酸素の電子箱図を見てみましょう。酸素の電子配置は 1s2 2s2 2p4 です。
合計で 8 個の電子があり、最外殻に 6 個あることがわかっています。窒素の場合と同様に、1s 軌道と 2s 軌道が満たされますが、2p 軌道を正しく満たすにはフントの法則を使用する必要があります。電子は、同じ軌道で別の電子とペアになる前に、常に自分の準軌道を占有します。したがって、2p 軌道の各電子は、2 つの電子がペアになる前に独自のボックスを取得します。ただし、今回は 4 つの 2p 電子と 3 つのボックスしかないため、左からペアリングを開始し、最後の 2 つの軌道にそれぞれ 1 つの電子を残します。
| O |  1 秒 1 秒 |  2 秒 2 秒 |    |
電子配置の例:塩素
ここで、フントの法則を、窒素や酸素よりも電子が数個多い元素でテストします。
| Cl |  1 秒 1 秒 |  2 秒 2 秒 |    2p 2p |  3 秒 3 秒 |    |
もう一度、ボックスがフントの規則に従って埋められていることを確認します。つまり、各価電子ボックスは、どのボックスも 2 つの電子を受け取る前に 1 つの電子を受け取ります。ご覧のように、塩素は n=3 殻を満たすのにあと 1 個の電子しか必要としないため、反応性が高くなります。たとえば、ナトリウムから食卓塩を形成するために、もう 1 つの電子を盗もうとします。
電子配置の例:マンガン
マン  1 秒
1 秒  2 秒
2 秒  2p
2p 

 3 秒
3 秒  4 秒
4 秒  3d
3d 




フントの法則は、ボックス ダイアグラムを作成するために 3d 軌道にアクセスする必要があるマンガンなどの多くの遷移金属にも当てはまります。
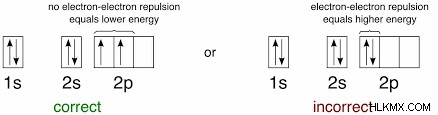
他の遷移金属化合物では、結晶場分裂と呼ばれる現象により、同じサブシェルにあるにもかかわらず、d 軌道が異なるエネルギーを持つようになります!これは、一般的な化学のカリキュラムでは通常、深く議論されることはありませんが、一部の物理化学および無機化学のコースでは主要な役割を果たします。これらの場合、一部の d 軌道のエネルギーが低いため、他の d 軌道にはまだ電子がなくても、それらが電子対で完全に満たされる方が実際にはより有利です。以下の簡単な回路図は、エネルギーの差 Δ0 を示しています。 そして結果として生じる異常な充填パターン.

フントの法則が成り立つ理由
すべての電子は負の電荷を持っており、同種の電荷は互いに反発します。電子はこの反発を最小限に抑えようとするため、別の電子と軌道を共有するのではなく、反発する電子が他にない軌道を常に占めたいと考えます。
すべての不対スピンが同じ方向に整列しなければならない理由は、スピンの性質に由来します。 2 つの平行なスピンが 2 つの反対のスピンよりも低いエネルギーを持つように、スピンは互いに相互作用します。これは、隣接する軌道に 2 つの電子を配置し、一方を上に、他方を下に向けると、エネルギーが高くなるため、原子の基底状態にはならないことを意味します。
ルールの発見
ドイツの物理学者フリードリッヒ・フントは、1927 年にこの規則を策定しました。当時、フントはロストック大学の講師でした。この頃、彼は分子軌道理論の基礎と量子トンネル現象も発見しました。
要素と材料を理解するための重要性
原子間のほとんどの反応中、最初の相互作用は、指定された原子の価電子間で発生します。最も安定した原子は、希ガスなどの完全な電子殻を持っています。ボックス図では、すべてのボックスが二重に埋められます。最も反応性の高い原子は、不完全な原子価殻を持っています。原子の化学的性質と反応性を決定するのは、これらの不対価電子です。一部の特性は、電子がより高いエネルギー準位に励起されてから通常の (基底状態) エネルギー準位に戻るときに要素によって放出される光の色など、価電子殻の完全性によっても決定されます。
磁気
フントの法則の最も重要な結果の 1 つは、磁気要素の存在です。不対電子のスピンは磁場と相互作用して整列できるため、不対電子を持つ要素を「常磁性」と呼びます。 ペアのみの要素 一方、電子には正味のスピンがありません。これは、すべての電子スピンが互いに打ち消し合うためです。これらの元素は磁場と相互作用せず、「反磁性」と呼ばれます。
これらの例は、フントの法則が元素の化学的および物理的特性を理解する上で重要であることを明確にしています!
関連チュートリアル:
- アウフバウ原則
- パウリ排除原則
- 電子配置の記述
- 電子軌道
http://www.kentchemistry.com/links/AtomicStructure/PauliHundsRule.htm の電子配置図