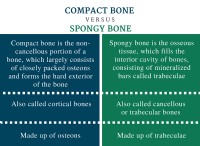
酸化マグネシウム(MGO)
の形成
酸化マグネシウム(MGO)は、マグネシウム(Mg)と酸素(O2)の間の反応によって形成されます。 。この反応は燃焼反応です 、つまり、それは物質と酸素と酸素の迅速な反応を伴い、熱と光を生成します。
これが反応の内訳です:
* 反応物: マグネシウム(Mg)と酸素(O2)
* 製品: 酸化マグネシウム(MGO)
化学式:
2 mg + O2→2 mgo
説明:
*マグネシウム(Mg)の2つの原子は、酸素(O2)の1つの分子と反応して、酸化マグネシウム(MGO)の2つの分子を形成します。
*この反応は多くの熱と光を放出し、マグネシウムリボンを明るく燃やします。
*このプロセスには、マグネシウム原子から酸素原子への電子の伝達が含まれ、イオン結合が形成されます。
層に伴う手順:
1。イグニッション: マグネシウムリボンは、ブンセンバーナーまたは他の熱源を使用して加熱されます。
2。反応: マグネシウムは、空気中の酸素と激しく反応し、酸化マグネシウムを生成します。
3。燃焼: 反応は熱と光を発生させ、マグネシウムリボンを明るい白い光で燃やします。
観測:
*マグネシウムリボンは、白い炎で明るく燃えます。
*反応の結果として、白い粉末状物質である酸化マグネシウムが形成されます。
*反応は発熱性であり、周囲に熱を放出します。
酸化マグネシウムの応用:
酸化マグネシウムには、以下を含む多数の用途があります。
* 耐火物: 融点が高いため、高温用途。
* 断熱材: 優れた熱および電気絶縁体。
* 薬: 制酸剤と下剤。
* 農業: 土壌修正。
注:
*反応は非常に発熱性であり、注意して実施する必要があります。
*この実験を実行しながら、常に適切な安全ゴーグルと手袋を着用してください。