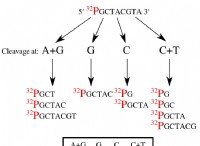
主な違い – 塩酸と硫酸
酸は、プロトンまたは H+ イオンを水溶液に供与できる分子です。酸には大きく分けて強酸と弱酸の2種類があります。塩酸と硫酸は2つの強酸です。塩酸と硫酸の主な違いは、塩酸は一塩基性ですが、硫酸は二塩基性です。
対象となる主な分野
1. 塩酸とは
– 定義、プロパティ
2. 硫酸とは
– 定義、プロパティ
3. 塩酸と硫酸の違いは何ですか
– 主な相違点の比較
重要な用語:化学式、ジプロトン、HCl、H2 SO4 、塩酸、イオン化、モノプロトン、硫酸 
塩酸とは
塩酸分子は、水素 (H) と塩素 (Cl) 原子で構成されています。塩酸の化学式は HCl として与えられます . HCl のモル質量は約 36.5 g/mol です。この酸は、水中の HCl ガスの無色の溶液です。強酸であるため、HCl は腐食性があり、取り扱いには注意が必要です。

図 01:塩酸
HCl は 1 つの HCl 分子あたり 1 つの H イオンを供与できます。つまり、それはモノプロトン (1 つのプロトンを放出できる) です。 HCl と水の間の反応は、以下のように与えられます。
HCl + H2 O → Cl + H3 O
HCl は大きな酸解離定数値 (K
NaOH(aq) + HCl(aq) → NaCl(aq) + H2 O(l)
上記の反応では、NaOH が塩基であり、NaCl が反応から形成される塩です。
それとは別に、塩酸は穏やかな還元剤です。 MnO2 などの強力な酸化剤と酸化還元反応を起こします。 .
MnO2(aq) + HCl(aq) → MnCl2(aq) + Cl2(g) + H2 O(l)
硫酸とは
硫酸は、水素 (H)、酸素 (O)、および硫黄 (S) 原子で構成される強酸です。 分子式 硫酸のH2として与えられる SO4 .硫酸は二塩基酸です。つまり、1 分子あたり 2 つの陽子を放出できるということです。硫酸のモル質量は約 98 g/mol です。これは非常に腐食性の溶液です。しかし、腐食性はその濃度に依存します。非常に低い濃度は有害ではないかもしれません.

図 01:硫酸の化学構造
硫黄分子には、非常に極性の高い 2 つの -O-H 結合があります。この極性のために、H 原子は容易に失われます。 イオン化 硫酸の分解は 2 段階で行われます。
H2 SO4(aq) + H2 O(l) → HSO4 (aq) + H3 O(aq)
HSO4 (aq) + H2 O(l) → SO4 (aq) + H3 O(aq)
硫酸は、濃縮状態では強力な酸化剤です。ただし、希釈すると酸化力が低下します。たとえば、高温では、濃硫酸は Br を酸化して Br2 にすることができます。 .
2HBr(aq) + H2 SO4(aq) → Br2(aq) + SO2(aq) + 2 H2 O(l)
塩酸と硫酸の違い
定義
塩酸: 塩酸は、水素原子と塩素原子から構成される強酸です。
硫酸: 硫酸は、水素、硫黄、酸素原子で構成される強酸です。
モル質量
塩酸: 塩酸のモル質量は約 36.5 g/mol です。
硫酸: 硫酸のモル質量は約 98 g/mol です。
陽子放出
塩酸: 塩酸は一塩基性で、1 分子あたり 1 つのプロトンを放出します。
硫酸: 硫酸は二塩基性で、1 分子あたり 2 つの陽子を放出します。
-OH基の存在
塩酸: 塩酸には -OH 基がありません。
硫酸: 硫酸には 2 つの -OH 基があります。
化学的性質
塩酸: 塩酸は穏やかな還元剤です。
硫酸: 硫酸は強力な酸化剤です。
結論
塩酸と硫酸の主な違いは、塩酸が一塩基性であるのに対し、硫酸は二塩基性であることです。塩酸と硫酸はどちらも、実験室での作業において非常に重要です。これらは酸であるため、これらの溶液の取り扱いには注意が必要です。