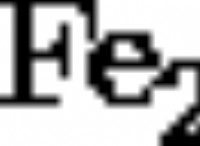1。電子の伝達:
-1つの原子、通常は金属で、はを失います 1つ以上の電子、A cation と呼ばれる正に帯電したイオンになります 。
- 別の原子、通常は非金属、ゲイン これらの電子は、アニオンと呼ばれる負に帯電したイオンになります 。
2。静電引力:
- 反対に帯電したイオンは、強い静電力を通して互いに引き付けられています。この魅力は、硬い結晶構造でイオンを一緒に保持します。
3。イオン化合物の形成:
- 結果の化合物は、正と負の電荷が互いにバランスをとるため、全体的に中性です。
キーポイント:
* 金属 電子を失い、陽イオンを形成する傾向があります。
* 非金属 電子を獲得し、陰イオンを形成する傾向があります。
*イオン結合は強いです ボンド、高い融点と沸点につながります。
*イオン化合物は通常、硬です および脆い 。
*イオン化合物は、溶融の場合に電気を伝達します または溶解 水中では、イオンが可動になると。
例:
塩化ナトリウム(NaCl)の形成を見てみましょう。
* ナトリウム(Na) 1つの価電子があり、 na+になるためにそれを失います イオン。
* 塩素(cl) 7つの価電子があり、1つを獲得して cl- イオン。
*反対に帯電したイオン、Na+とCl-は互いに強く引き付け、イオン化合物 naCl を形成します (食塩)。
要約: イオン結合は、電子が原子間で伝達され、静電力を通して互いに引き付けられる反対に帯電したイオンを作成するプロセスです。これにより、一意の特性を持つ安定したイオン化合物が形成されます。