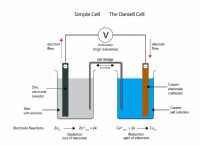
これが故障です:
* 酸: 溶液中に水素イオン(H+)を寄付する物質。
* ベース: 溶液中の水素イオン(H+)を受け入れる物質。
* 塩: 酸からの水素イオンが塩基から水酸化物イオン(OH-)と結合するときに形成されるイオン化合物。
* 水: 酸からの残りの水素イオンが、塩基からの残りの水酸化物イオンと結合したときに形成されます。
例:
* 塩酸(HCl) +水酸化ナトリウム(NAOH)→塩化ナトリウム(NaCl) +水(H₂O)
この反応で:
* HClは酸であり、H+イオンを寄付します。
* NaOHはベースであり、H+イオンを受け入れ、OHイオンを提供します。
* NaClは形成された塩です。
*h₂oは形成された水です。
重要な注意:
*酸と塩基の間の反応は発熱性であり、熱を放出します。
*酸と塩基の強度は、結果として得られる溶液の程度とpHを決定します。
*すべての酸塩基反応が塩と水を生成するわけではありません。一部の反応は、関連する特定の酸とベースに応じて他の製品を形成する可能性があります。