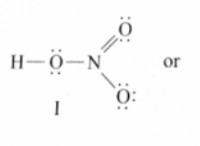
1。電気陰性度:
* 金属: 金属の電気陰性度は低いため、電子の魅力が弱いことを意味します。彼らは電子を簡単に失う傾向があります。
* 非金属: 非金属は電気陰性度が高いため、電子に強い魅力があります。彼らは電子を簡単に獲得する傾向があります。
2。電子構成:
* 金属: 金属には通常、1〜3個の価電子(最も外側のシェルの電子)があります。これらの電子を失うと、安定した完全な外側シェル構成が実現します。
* 非金属: 非金属は、しばしば完全な外側のシェルを達成するためにいくつかの電子を欠いています。彼らは外側のシェルを完成させるために電子を獲得する傾向があります。
3。反応:
金属が非金属と反応すると、金属原子は1つ以上の電子を失い、正の帯電イオン(陽イオン)になります。非金属原子はこれらの電子を獲得し、負に帯電したイオン(アニオン)になります。この電子の伝達は、イオン結合と呼ばれます 。
例:
グループ1のナトリウム(NA)は、グループ17の塩素(CL)と反応します。
*ナトリウム(Na)は1つの電子を失い、ナトリウムイオン(Na+)になります。
*塩素(Cl)は1つの電子を獲得して塩化物イオン(Cl-)になります。
反対に帯電したイオンは互いに引き付けられ、イオン結合を形成します。得られた化合物である塩化ナトリウム(NaCl)はイオン化合物です。
キーポイント:
* 静電引力: イオンの反対の電荷は、化合物を一緒に保持し、強い静電引力を生み出します。
* 結晶構造: イオン化合物は、通常、強力な静電力のために剛性のある結晶構造を形成します。
* 高融点と沸点: イオン化合物は、一般に、イオン間の強い静電引力のために高い融点と沸点を持っています。
要約:
電気陰性度と電子構成の違いにより、金属と非金属間の電子の伝達が促進され、イオン化合物の形成が生じます。結果として生じる反対に帯電したイオン間の静電引力は、イオン結合の基礎です。