主な違い – Valency と Covalency
原子は物質の構成要素です。すべての原子は原子核と電子雲で構成されています。原子核は原子の核であり、電子雲に囲まれています。電子雲の概念は、電子の位置の確率に基づいて進化しています。これは、電子が原子核の周りを常に動いていることを意味します。この経路は、軌道またはシェルと呼ばれます。電子はこれらの軌道に沿って移動していると言われています。原子価と共有原子価は、原子に存在する電子の数に関連する 2 つの用語です。原子価と共有原子価の主な違いは、原子価とは、原子がそれ自体を安定させるために失うまたは獲得する電子の数であるのに対し、共有原子価とは、原子が空の軌道を使用して形成できる共有結合の最大数 .
対象となる主な分野
1.ヴァレンシーとは
– 定義、プロパティ、例
2.共有性とは
– 定義、プロパティ、例
3. Valency と Covalency の違いは何ですか
– 主な違いの比較
重要な用語:原子、共有結合、共有結合、電子、軌道、シェル、原子価 
価数とは
原子価は、原子がそれ自体を安定させるために失う、または獲得する電子の数として定義できます。原子の最も外側の軌道にある電子は、価電子として知られています。場合によっては、価電子の数がその元素の価数と見なされます。たとえば、水素 (H) の原子価は 1 です。これは、水素原子が 1 つの電子を失うか獲得することによって安定化できるためです。塩素原子は最外軌道に7個の電子を持っていますが(価電子数は7個)、さらに1個電子を獲得することで、より安定なアルゴン(Ar)の希ガス電子配置を得ることができます。 7 個の電子を失うよりも 1 個の電子を得やすいため、塩素の価数は 1 と見なされます。
元素の電子配置によって、特定の元素の原子価が決まります。次の表は、いくつかの元素とその原子価を示しています。
| 要素 | 電子配置 | オクテット規則に従うために電子を取得または解放する必要がある | 価数 |
| ナトリウム (Na) | 1s2s2p3s | (-)1 | 1 |
| カルシウム (Ca) | 1s2s2p3s3p4s | (-)2 | 2 |
| 窒素 (N) | 1s2s2p | (+)3 | 3 |
| 塩素 (Cl) | 1s2s2p3s3p | (+)1 | 1 |
上の表は、いくつかの要素の原子価を示しています。そこでは、(-) マークは、安定させるために取り除かなければならない電子の数を示しています。 (+) マークは、安定化するために取得する必要がある電子の数を示します。
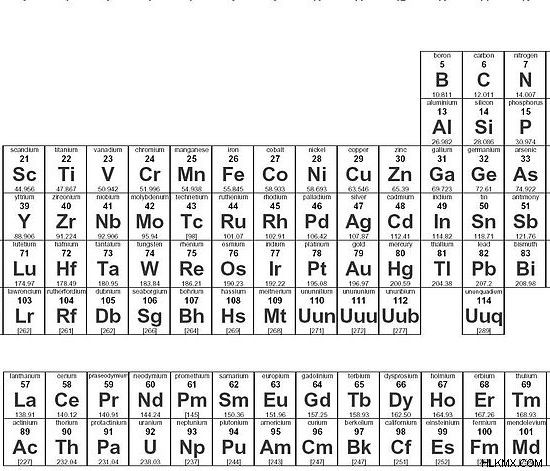
図 1:元素の周期表
それとは別に、元素の周期表は元素の原子価についてのアイデアを与えることもできます。グループ 1 の要素は常に原子価 1 を持ち、グループ 2 の要素の原子価は 2 です。
共有性とは
共有結合は、原子が空軌道を使用して形成できる共有結合の最大数です。共有結合は、要素の価電子の数に依存します。たとえば、水素に存在する価電子の数は 1 であり、共有結合を形成するために別の原子と共有できる電子が 1 つしかないため、水素の共有原子価も 1 です。
炭素などの元素を考えると、炭素の電子配置は1s2s2pです。炭素の価電子の数は 4 です。空の p 軌道があります。したがって、2s軌道の2つのs電子を分離して、これらのp軌道に含めることができます。次に、炭素には 4 つの不対電子があります。したがって、炭素には、共有結合を形成するために共有される4つの電子があります。したがって、炭素の共有結合は 4 です。これは、炭素原子が持つことができる共有結合の最大数です。これは、以下に示す軌道図で説明されています。
炭素の価電子。 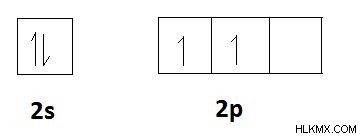
空軌道への電子の広がり。 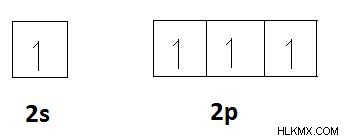
現在、共有結合を形成するために、炭素が他の原子と共有する 4 つの不対電子があります。
Valency と Covalency の違い
定義
価数: 原子価とは、原子がそれ自体を安定させるために失う、または獲得する電子の数です。
共有: 共有結合は、原子が空軌道を使用して形成できる共有結合の最大数です。
価電子との関係
価数: 原子価は、価電子の数に等しいか、等しくないかのいずれかです。
共有: 共有結合は、価電子の数に依存します。
空の軌道
価数: 原子価は、空の軌道を満たすために必要な電子の数を示します。
共有: 共有結合は、原子に存在する空の軌道の数に依存します。
結合の種類
価数: 原子価は、イオン結合または共有結合のいずれかを形成できる元素に与えることができます。
共有: 共有結合は、共有結合を形成できる元素に対してのみ付与できます。
結論
原子価は、原子の価電子の数と等しい場合もありますが、ほとんどの場合は異なります。ただし、共有結合は原子の価電子の数に完全に依存します。これは、価電子が原子が持つことができる共有結合の数を決定するためです。したがって、結合価と共有結合の違いを知ることが重要です。







