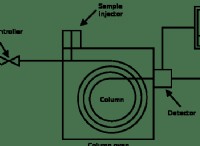
pHと酸強度の理解
* ph: 溶液中の水素イオン(H+)濃度の尺度。 pH値が低いことは、より高いH+濃度を示しています。これは、より酸性溶液を意味します。
* 強酸: 溶液中に完全にイオン化します。つまり、すべての水素イオンを寄付します。 例:HCL、HNO3、H2SO4。
* 弱酸: 溶液中に部分的にのみイオン化します。つまり、水素イオンのごく一部しか寄付しません。例:酢酸(CH3COOH)、炭酸酸(H2CO3)。
推論
1。 pH 3: 3のpHは比較的酸性です。これは、H+イオンが著しく濃度があることを意味します。
2。強酸: 少量の強酸でさえ、多数のH+イオンが放出され、pHが低くなります。
3。弱酸: 希薄な弱酸は、少量のH+イオンのみを放出し、強酸よりも高いpHをもたらします。
結論
pH 3の溶液は、希釈強酸の可能性が高くなります 。
確認するために、
* 滴定: 既知の塩基と反応することにより、酸の濃度を決定します。
* 導電率: 溶液の電気伝導率を測定します。強酸は、より多くの遊離イオンの存在により、導電率が高くなります。
* 化学試験: 特定の化学試験を実行して、酸を特定し、その強度を決定します。
重要な注意: 例外があります。 3のpHを生成する濃縮弱酸を持つことは可能ですが、希釈性強酸よりも一般的ではありません。