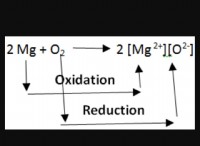
エントロピーの理解
* エントロピー(s) システム内の障害またはランダム性の尺度です。障害が多いほど、エントロピーが高くなります。
* 固体 分子がしっかりと詰め込まれた高度に秩序化された構造を持っています。
* ガス(g) 分子が広がって自由に動いている状態で、はるかに秩序化された構造がはるかに少ない。
反応
反応i₂(s)→i₂(g)は昇華を表します ヨウ素(i₂)のガス状ヨウ素へ。エントロピーに何が起こるかは次のとおりです。
* 初期状態(i₂(s)) :固体ヨウ素は、その秩序化された構造のためにエントロピーが低い。
* 最終状態(i₂(g)) :分子が遠く離れて自由に動いているため、ガス状のヨウ素はエントロピーが大幅に高くなっています。
結論
エントロピーが増加します ヨウ素の昇華中。高度に秩序化された固体状態から、あまり秩序化されていないガス状の状態に移行すると、ランダム性が大幅に増加し、したがってエントロピーが発生します。