主な違い - ヒドロキシルとアルコール
有機化合物は、基本的に C 原子と H 原子で構成される分子です。これらの分子に結合した O や N などの他の原子が存在する可能性があります。アルコールは、C、H、および O 原子で構成される分子です。アルコールの特徴は、アルキル基に結合したヒドロキシル基 (-OH) の存在です。官能基は、特定の分子の特性と反応を決定する原子のグループです。ヒドロキシル基は、アルコールなどの有機および無機化合物に存在する官能基です。分子の酸性度または塩基性度は、分子内のヒドロキシル基の位置によって異なります。しかし、IUPAC 命名法 (国際純粋応用化学連合 (IUPAC) によって導入された化合物の命名方法) によると、ヒドロキシルという用語はヒドロキシルラジカルを表します。ただし、ヒドロキシル基とヒドロキシルラジカルの両方にこの用語を使用します。ヒドロキシルとアルコールの主な違いは、a ヒドロキシルは官能基ですが、アルコールは有機化合物です。
対象となる主な分野
1.ヒドロキシルとは
– 定義、形成、およびプロパティ
2.アルコールとは
– 定義、プロパティ、および反応
3.ヒドロキシルとアルコールの関係
– ヒドロキシルとアルコール
4.ヒドロキシルとアルコールの違いは何ですか
– 主な相違点の比較
キーワード:アルコール、ヒドロキシル、ヒドロキシル基、ヒドロキシルラジカル
ヒドロキシルとは
IUPAC命名法によると、ヒドロキシルという用語はの命名に使用されます OHラジカル。しかし、一般的に、すべての-OH基をヒドロキシル基と呼びます.ヒドロキシル基は、有機化合物と無機化合物の両方に見られる官能基です。化学式は–OHとして与えられます。したがって、ヒドロキシル基は、1つの水素原子と1つの酸素原子で構成されています。場合によっては、ヒドロキシル基の存在が分子の酸性度を示します。また、分子の塩基性を示す場合もあります。
ヒドロキシルラジカルは反応性が高く、化学反応を素早く起こすことができます。ヒドロキシルラジカルは、水酸化物イオンの中性形態です。このヒドロキシルラジカルには、ラジカルの高い反応性を引き起こす不対電子があります。

図 1:ベンゼンとヒドロキシル ラジカルの反応
アルコールやカルボン酸などの有機化合物には、この -OH 基が見られます。水酸基がアルコールにある場合、アルコール基と呼ばれます。ヒドロキシル基がカルボン酸にある場合、それはカルボキシル基と呼ばれます。これらの化合物では、ヒドロキシル基は共有結合を介して分子の残りの部分に結合しています。アルコールでは、ヒドロキシル基がアルコールの特性を決定します。
無機化合物では、ヒドロキシル基が共有結合またはイオン結合のいずれかを介して分子の残りの部分に結合していることがわかります。 H2 などの分子では お、H2 SO4 など、ヒドロキシル基は共有結合を介して結合されています。 NaOH やその他の金属水酸化物などの化合物では、ヒドロキシル基はイオン結合を介して結合しています。
アルコールとは
アルコールは、アルキル基に水酸基が結合した有機化合物です。アルコールの官能基は水酸基です。アルコールは、C、H、および O 原子で構成されています。アルコールの構造によると、アルコールには次のような 3 つの主要な種類があります。
第一級アルコール
- 第一級アルコールは、ヒドロキシル基に結合した炭素原子、2 つの水素原子、および 1 つのアルキル基で構成されます。
二級アルコール
- 第 2 アルコールは、ヒドロキシル基に結合した炭素原子、1 つの水素原子、および 2 つのアルキル基で構成されます。
第三級アルコール
- 第 3 級アルコールは、ヒドロキシル基と 3 つのアルキル基に結合した炭素原子で構成されています。
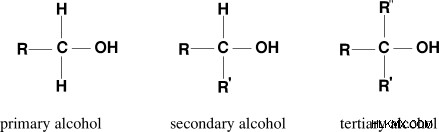
図 02:アルコールの種類
アルコールはヒドロキシル基の存在により極性化合物です。したがって、極性溶媒に溶解することができます。アルコールは水素結合を形成することもできます。これらの水素結合の存在により、アルコールの沸点が対応するアルカンよりも高くなります。アルコールの例としては、メタノール、エタノール、ブタノールがあります。
アルコールは、主成分または微量成分として飲料に含まれています。それとは別に、一部の医薬品にはアルコールが含まれています。複数のヒドロキシル基を持つアルコールは、ポリオールと呼ばれます。
ヒドロキシルとアルコールの関係
アルコールはヒドロキシル基で構成されています。これらのヒドロキシル基は、アルコールの官能基として機能します。したがって、ヒドロキシル基はアルコールの化学的および物理的特性を決定します。以下に示すのは、ヒドロキシル基の存在によって生じるアルコールの特性を説明するいくつかの例です。
- アルコールはヒドロキシル基の存在により極性化合物です。
- アルコールは極性溶媒に溶けます。
- アルコールは水素結合を形成できます。
- アルコールは水に溶けます。
- アルコールは、これらの水素結合が存在するため、対応するアルカンよりも沸点が高くなります。
ヒドロキシルとアルコールの違い
定義
ヒドロキシル: ヒドロキシルは、 の命名に使用される IUPAC 名です。 OHラジカル。
アルコール: アルコールは、アルキル基に結合したヒドロキシル基で構成される有機化合物です。
自然
ヒドロキシル: 水酸基は官能基です。
アルコール: アルコールは有機化合物です。
原子
ヒドロキシル: ヒドロキシル基は、H 原子と O 原子で構成されています。
アルコール: アルコールは、C、H、および O 原子で構成されています。
反応性
ヒドロキシル: ヒドロキシルラジカルは反応性が高いです。
アルコール: アルコールは、ヒドロキシルラジカルに比べて反応性が低いです.
結論
ヒドロキシル基の名前としてヒドロキシルという用語を使用していますが、これは IUPAC 命名法によるヒドロキシル ラジカルの名前です。ただし、それは依然としてヒドロキシル基の命名に使用される一般的な名前です.アルコールは、ヒドロキシル基で構成される有機化合物です。ヒドロキシルとアルコールの主な違いは、ヒドロキシルが官能基であるのに対し、アルコールは有機化合物であることです。







