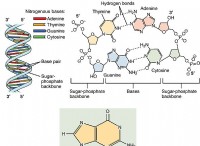
基本を理解する
* ナトリウム(Na): ナトリウムには、最も外側のシェル(価電子)に1つの電子があります。ナトリウムがこの電子を失い、安定した完全な外側のシェルを達成するのは比較的簡単です。
* 塩素(cl): 塩素には、最も外側の殻に7つの電子があります。外側のシェルを完成させて安定するには、もう1つの電子が必要です。
相互作用
1。静電引力: ナトリウムと塩素が近づくと、塩素原子の正に帯電した核は、ナトリウム原子の負に帯電した価電子を引き付けます。
2。電子伝達: 強い引力により、ナトリウム原子がその価電子を失い、それが塩素原子に伝達されます。
3。イオン形成:
* ナトリウム(Na)は正の帯電イオン(Na+)になります: 電子を失うと、ナトリウム原子が負電荷を1つ少なくしているため、正味の正電荷が発生します。
* 塩素(Cl)は負に帯電したイオン(Cl-)になります: 電子を獲得すると、塩素原子に余分な負電荷が得られ、純負電荷が得られます。
結果:イオン結合
反対に帯電したナトリウムと塩素イオンは、静電力のために互いに強く引き付けられています。このアトラクションは、イオン結合と呼ばれます 、塩化ナトリウム(NaCl)と呼ばれる化合物を形成します 、一般的なテーブルソルトです。
視覚化
* ナトリウム原子: 価電子電子を表す1つのドットの小さな球体を想像してください。
* 塩素原子: 原子価電子を表す7つのドットの大きな球体を想像してください。
* 電子移動: ナトリウムの価電子を表すドットは、塩素原子に移動し、ナトリウム球に正の兆候と負の兆候を持つ塩素球を残します。
キーポイント:
* 安定性: イオンの形成により、ナトリウムと塩素の両方が完全な外側の殻を持つ安定した電子構成を実現することができます。
* 静電力: 反対に帯電したイオン間の魅力は、イオン化合物の形成の背後にある駆動力です。
詳細が必要な場合、または図を表示したい場合はお知らせください!