その理由は次のとおりです。
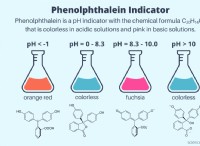
* pHおよび水素イオン: pHは、溶液の酸性度またはアルカリ度の尺度です。低いpHは、水素イオン(H+)の濃度が高いことを示し、溶液を酸性にします。 pHが高いほど、H+イオンの濃度が低いことを示し、溶液アルカリ(塩基性)になります。
* バッファと平衡: バッファーは、弱酸とその共役塩基(または弱い塩基とその共役酸)を含む溶液です。 それらは、水素イオン濃度の変化に対抗するために、酸と塩基形態の間の平衡をシフトすることによって機能します。
* H+イオンの追加: H+イオンがバッファー溶液に添加されると、コンジュゲート塩塩塩塩塩はそれらと反応して弱酸を形成します。これにより、pHの変化が減少します。
* H+イオンの除去: H+イオンが緩衝液から除去されると、弱酸はH+イオンを寄付し、失われた水素イオンを補充します。これは再びpHの変化を最小限に抑えます。
一般的なバッファーの例:
* 重炭酸塩緩衝液: これは、血液のpHを維持するために不可欠です。
* リン酸緩衝液: これは、細胞内のpHを維持するために重要です。
* Trisバッファー: これは、実験室アプリケーションで広く使用されているバッファーです。
バッファーや特定の例についてもっと知りたい場合はお知らせください!