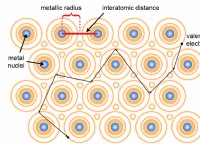
水中の弱酸とイオン化
強酸とは異なり、弱酸は水中で完全にイオン化しないでください。代わりに、それらは彼らの非組織化された形(ha)とイオン化された形(h⁺およびa⁻)との間に平衡に存在します。
プロセスの内訳は次のとおりです。
1。平衡:
*弱酸(HA)が水に加えられると、可逆反応が起こります。
ha(aq)⇌h⁺(aq) +a⁻(aq)
*二重矢印(⇌)は、反応が両方向に同時に進行することを示します。
*酸(ha)はプロトン(h⁺)を水に寄付し、ハイドロニウムイオン(h₃o⁺)とコンジュゲートベース(a⁻)を形成します。
2。限られたイオン化:
*強酸とは異なり、弱酸は水中で部分的にしかイオン化しません。
*これは、酸性分子のほとんどが非関連型(HA)のままであることを意味します。
*イオン化の程度は、酸解離定数(ka)によって記述されています 。
3。酸解離定数(KA):
* Kaは、弱酸の強度の尺度です。
*これは、イオン化反応の平衡定数です。
ka =[h⁺] [a⁻] / [ha]
* KA値が大きいほど強い酸を示します。つまり、より広範囲にイオン化します。
* KA値が小さいことは、より弱い酸を示します。つまり、それはより広くイオン化することを意味します。
4。イオン化に影響する要因:
* 温度: 温度の上昇は、一般に弱酸のイオン化を増加させます。
* 濃度: 弱酸溶液を希釈すると、イオン化が増加します。
* 一般的なイオンの存在: コンジュゲートベース(a⁻)を含む塩を弱酸溶液に追加すると、イオン化が減少します。
5。例:
*酢酸(Ch₃COOH)は一般的な弱酸です。水中のイオン化は、次のように表現できます。
ch₃cooh(aq)⇌h⁺(aq) +ch₃coo⁻(aq)
*酢酸のKa値は1.8 x 10°で、それは弱酸であり、その分子のわずかな部分しか水でイオン化していることを示しています。
要約:
*弱酸は水中で部分的にイオン化し、それらの非組織化された形態とイオン化された形態の間に平衡を確立します。
*イオン化の程度は、酸解離定数(KA)によって決定されます。
*温度、濃度、一般的なイオン効果を含むいくつかの要因が、弱酸のイオン化に影響を与える可能性があります。