コア コンセプト
このチュートリアルでは、金属結合、その特性と特性について学び、さらにいくつかの例を学びます!
他の記事で取り上げるトピック
- イオン結合と共有結合
- 極性結合と非極性結合
- 金属、非金属、半金属
- 結合エンタルピーと結合エネルギー
- 極性共有結合
金属結合の定義
簡単な答え:金属結合は、2 つ以上の金属原子間の化学結合の一種であり、正に帯電した金属核とそれらの非局在化された価電子の間の引力から生じます。
この記事の残りの部分では、この定義のさまざまな部分を見て、その意味を分析し、金属結合相互作用の結果を探ります!
金属結合とは?
金属結合はではない 特定の原子間の個別の方向性結合であるため、個々の結合ではなく、金属の「結合」について話すことが理にかなっていることがよくあります。しかし、この種の結合の特徴は何ですか?まず、名前が示すように、このタイプの結合は金属や金属合金に見られます。金属と非金属間の結合は通常イオン結合ですが、非金属間の結合は通常共有結合です。しかし、金属原子のみを含む物質では、関与する相互作用は異なる性質を持ち、これを金属結合と呼びます.
金属接合の特徴
金属元素は電気陰性度が低いため、価電子をゆるやかに保持しています。これが、電気陰性原子の周りの価電子を放棄してイオン化合物を形成する理由です。その結果、周囲に金属原子しかない場合、1 つの原子の価電子を隣接する原子の価電子と区別することは困難です。金属片のすべての原子はこれらの電子を共有し、材料全体を自由に流れることができます.多くの人が「電子の海」という用語を使用して、この共有された価電子のプールを指します。下の図では、黄色の等高線がこの電子の海を電子密度で近似的に表しています。
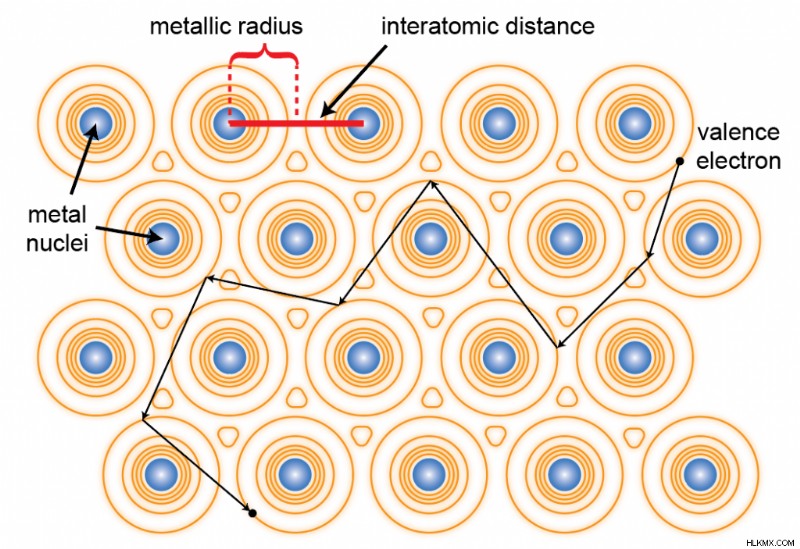
共役π系のように、共有結合化合物を介して電子が流れる場合があります。ただし、これは特定の結合に沿った電子の非局在化によるものであり、材料全体での電子の一般的な共有によるものではありません。
金属結晶構造
金属結合のもう 1 つの特徴は、最も近い隣接原子がすべて同じように結合することです。これは、金属結晶が通常、六方最密充填や立方最密充填などの最密パターンで組織化されることを意味します.
金属特性
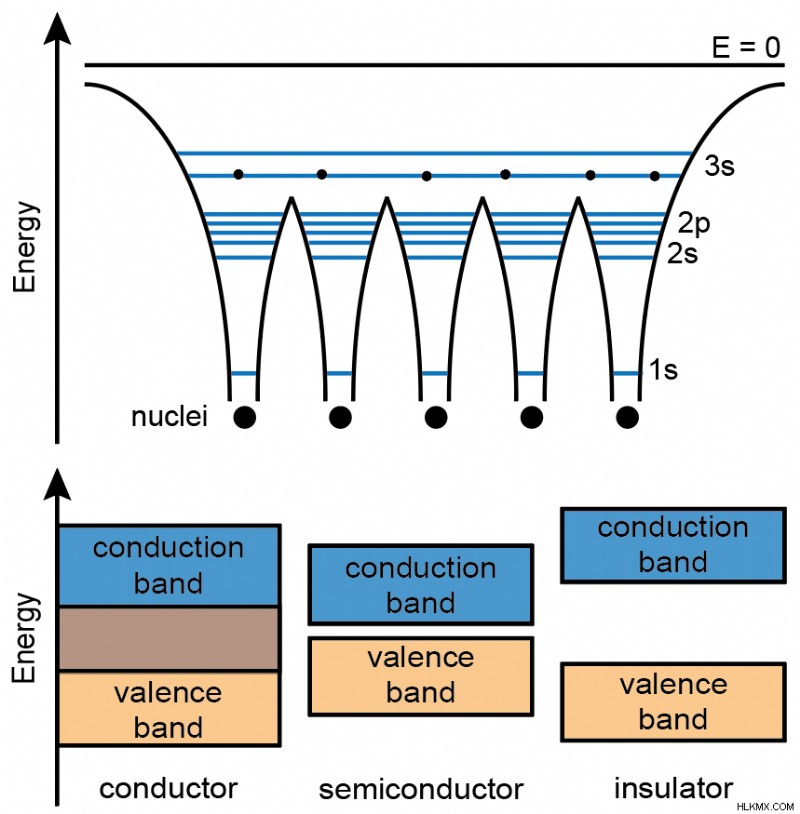
金属の特性の多くは、金属結合の性質に由来します。これらの中には、電気伝導性、熱伝導性、および光沢があります。
電気伝導とは、電位差に応じて材料を介して電子が移動することです。電気伝導度は、主に金属の伝導帯の電子から生じます。電子は常に金属の伝導帯に存在するため、常に効率的に電荷を転送できます。
金属の高い熱伝導率は、電子移動度にも由来します。原子自体が熱伝達に寄与しますが、電子も運動エネルギーを吸収して伝達します。
金属の光沢は、固体の表面にある高密度の電子に由来します。入ってくる光子は、これらの電子を透過または吸収するよりも反射する可能性が高くなります。
金属結合の例
- ナトリウムやカリウムなどのアルカリ金属
- カルシウムやマグネシウムなどのアルカリ土類金属
- 鉄、チタン、金、タングステン、銅、亜鉛などの遷移金属
- ブロンズ、ピューター、ステンレス、エレクトラム、ジュラルミンなどの合金







