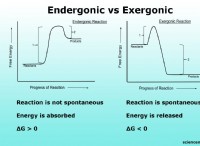
1。ロンドン分散部隊(LDF):
* すべての分子に存在します。
* IMFの最も弱いタイプ。
*電子分布の一時的な変動から生じ、一時的な双極子が生成されます。
*分子サイズと表面積の増加とともに強度は増加します。
2。双極子ダイポール力:
* 極地分子(永久双極子の分子)に存在します。
* LDFよりも強い。
*ある双極子の正の端と別の双極子の負の端の間の引力から生じます。
*極性の増加とともに強度は増加します。
3。水素結合:
* 特別なタイプの双極子 - 双極子相互作用。
* 最も強いタイプのIMF。
*水素原子が高強性原子(N、O、またはF)に結合されたときに発生します。
*水素原子は、隣接する分子の電気陰性原子に孤立した電子のペアとの弱い結合を形成します。
例:
* 水(h₂o): 水素結合
* メタン(Ch₄): ロンドン分散部隊
* エタノール(c₂h₅oh): 水素結合および双極子型力
* 二酸化炭素(CO₂): ロンドンの分散部隊と双極子双極子の力
* アセトン(ch₃coch₃): 双極子ダイポールの力とロンドン分散部隊
重要なメモ:
* IMFの強度は、沸点、融点、粘度など、物質の物理的特性に直接影響します。
*より強いIMFは、より高い沸点と融点につながります。
*水素結合を持つ物質は、一般に、双極子型力のみを持つ物質よりも沸点が高い。
この説明が役立つことを願っています!他に質問がある場合はお知らせください。